Содержание
Преэклампсия и HELLP-синдром как проявление тромботической микроангиопатии » Акушерство и Гинекология
Тромботическая микроангиопатия представляет собой одно из наиболее тяжело протекающих тромботических осложнений, характеризующееся поражением микрососудов различных органов и сопровождающееся тромбоцитопенией и гемолитической анемией. Термин тромботическая микроангиопатия вобрал в себя несколько нозологий, для которых характерны разные механизмы возникновения микротромбоза. В настоящее время к тромботической микроангиопатии относят тромботическую тромбоцитопеническую пурпуру (ТТП), гемолитико-уремический синдром (ГУС), гепарин-индуцированную тромбоцитопению, HELLP-синдром. Одним из важнейших триггеров возникновения тромботической микроангиопатии является беременность. Этот факт открывает широкие перспективы в изучении патогенеза тромботической микроангиопатии в контексте физиологических изменений гемостаза во время беременности. В то же время открытие молекулярных механизмов тромботической микроангиопатии позволяет по-новому взглянуть на патогенез тромботических осложнений, связанных с беременностью, а также на патогенез так называемых плацентарных акушерских осложнений, в том числе тяжелых форм преэклампсии.
Понятие о тромботической микроангиопатии и тромботической тромбоцитопенической пурпуре
В настоящее время тромботическая тромбоцитопеническая пурпура (ТТП) и гемолитико-уремический синдром (ГУС) рассматриваются как проявления тромботической микроангиопатии. Тромботическая микроангиопатия морфологически проявляется утолщением стенок сосудов микроциркуляторного русла (преимущественно капилляров и артериол), отеком и слущиванием эндотелиальных клеток от базальной мембраны, образованием тромбоцитарных сгустков и частичной или полной обструкцией просвета пораженного сосуда, при этом периваскулярное воспаление не характерно, а тромбы состоят почти исключительно из тромбоцитов. Обструкция просвета сосудов приводит к развитию ишемии и инфарктов органов. Характерным признаком тромботической микроангиопатии является тромбоцитопения и гемолитическая анемия, что связано с потреблением и разрушением тромбоцитов и эритроцитов в микроциркуляторном русле [1, 2].
ТТП характеризуется тромбоцитопенией, микроангиопатической анемией, лихорадкой, поражением почек и неврологической симптоматикой. Неврологические проявления ТТП крайне разнообразны и варьируют от небольших нарушений поведения и затуманенности сознания до выраженных сенсорно-моторных нарушений, афазии, судорог и комы. Кроме того, при ТТП могут наблюдаться боли в животе, панкреатит, гематурия, нарушения сердечного ритма, нарушения зрения. Для ГУС также характерна тромбоцитопения и микроангиопатическая гемолитическая анемия, но с преимущественным поражением почек.
Неврологические проявления ТТП крайне разнообразны и варьируют от небольших нарушений поведения и затуманенности сознания до выраженных сенсорно-моторных нарушений, афазии, судорог и комы. Кроме того, при ТТП могут наблюдаться боли в животе, панкреатит, гематурия, нарушения сердечного ритма, нарушения зрения. Для ГУС также характерна тромбоцитопения и микроангиопатическая гемолитическая анемия, но с преимущественным поражением почек.
После внедрения терапии свежезамороженной плазмой и значительного снижения летальности у больных ТТП удалось проследить дальнейшую судьбу этих пациентов, и стало очевидно, что этиология ТТП характеризуется значительным разнообразием, как и дальнейшее течение этого заболевания. В настоящее время выделяют наследственную (семейную, врожденную) форму ТТП, которая носит название синдрома Апшоу–Шульмана и обусловлена генетическим дефектом протеазы vWF – ADAMTS-13, и приобретенную форму ТТП, обусловленную формированием антител к ADAMTS-13 или ее ингибитора [3]. Мутации в гене ADAMTS-13 вызывают значительное снижение уровня этого фермента в плазме крови или выраженное нарушение его активности. При тяжелом генетически обусловленном дефиците ADAMTS-13 эпизоды ТТП могут начаться с раннего детства, однако у ряда больных заболевание может долго себя не проявлять вплоть до воздействия какого-либо сильного провоцирующего фактора. Например, триггером для развития первого эпизода ТТП у таких больных может стать беременность, различные инфекционные заболевания и септические состояния, сопровождающиеся массивным выбросом провоспалительных цитокинов, а также прием оральных контрацептивов, так как содержащиеся в них эстрогены стимулируют выброс ультравысокомолекулярных мультимеров vWF из эндотелиоцитов. У ряда больных с выраженным наследственным дефицитом ADAMTS-13 (активность ADAMTS-13 в плазме крови менее 5–10%) ТТП принимает хроническое рецидивирующее течение с рождения, а ведущим синдромом становится прогрессирующая почечная недостаточность. При редкой врожденной форме ТТП рецидивы могут возникать каждые 3–4 недели.
Мутации в гене ADAMTS-13 вызывают значительное снижение уровня этого фермента в плазме крови или выраженное нарушение его активности. При тяжелом генетически обусловленном дефиците ADAMTS-13 эпизоды ТТП могут начаться с раннего детства, однако у ряда больных заболевание может долго себя не проявлять вплоть до воздействия какого-либо сильного провоцирующего фактора. Например, триггером для развития первого эпизода ТТП у таких больных может стать беременность, различные инфекционные заболевания и септические состояния, сопровождающиеся массивным выбросом провоспалительных цитокинов, а также прием оральных контрацептивов, так как содержащиеся в них эстрогены стимулируют выброс ультравысокомолекулярных мультимеров vWF из эндотелиоцитов. У ряда больных с выраженным наследственным дефицитом ADAMTS-13 (активность ADAMTS-13 в плазме крови менее 5–10%) ТТП принимает хроническое рецидивирующее течение с рождения, а ведущим синдромом становится прогрессирующая почечная недостаточность. При редкой врожденной форме ТТП рецидивы могут возникать каждые 3–4 недели. Такую форму заболевания часто называют хронической рецидивирующей ТТП. У двух третей больных с относительно более распространенной приобретенной формой ТТП в случае успешной терапии повторные эпизоды не возникают, тогда как у трети больных развиваются рецидивы [4]. Когда именно разовьется рецидив, предсказать невозможно. Период ремиссии может длиться от нескольких дней до десятков лет, однако наиболее часто рецидив развивается в течение года после первого эпизода ТТП. Триггером к развитию рецидива могут служить беременность, хирургическое вмешательство, инфекция, вакцинация.
Такую форму заболевания часто называют хронической рецидивирующей ТТП. У двух третей больных с относительно более распространенной приобретенной формой ТТП в случае успешной терапии повторные эпизоды не возникают, тогда как у трети больных развиваются рецидивы [4]. Когда именно разовьется рецидив, предсказать невозможно. Период ремиссии может длиться от нескольких дней до десятков лет, однако наиболее часто рецидив развивается в течение года после первого эпизода ТТП. Триггером к развитию рецидива могут служить беременность, хирургическое вмешательство, инфекция, вакцинация.
В настоящее время принята следующая классификация тромботических микроангиопатий (табл. 1).
Молекулярные основы патогенеза тромботической микроангиопатии
Moake и соавт. в 1982 г. впервые выявили аномальные мультимерные комплексы vWF у пациентов с ТТП и сделали предположение о возможной роли vWF в патогенезе ТТП [5]. Характерным признаком ТТП является дефицит плазменной протеазы, расщепляющей мультимеры vWF – ADAMTS-13. При семейных формах ТТП наблюдается наследственный дефект этого фермента, в то время как приобретенные формы ТТП характеризуются наличием антител-ингибиторов vWF-протеазы [6].
При семейных формах ТТП наблюдается наследственный дефект этого фермента, в то время как приобретенные формы ТТП характеризуются наличием антител-ингибиторов vWF-протеазы [6].
Фактор Виллебранда представляет собой высокомолекулярный мультимер, образующийся при полимеризации мономерных субъединиц с молекулярной массой 225 кДа в эндотелиальных клетках и мегакариоцитах и накапливающийся в тельцах Weibel-Palade в эндотелиальных клетках и а-гранулах тромбоцитов. Эти ультравысокомолекулярные мультимеры vWF (ULVWF) секретируются активированными эндотелиоцитами наподобие «лент». В норме эти «ленты» высокомолекулярных комплексов vWF сразу после экспрессии на плазматической мембране подвергаются распаду на фрагменты с Мг 189, 176 и 140 кДа под действием плазматической металлопротеазы ADAMTS-13 и, следовательно, в циркулирующей крови не обнаруживаются [3]. Физиологическая роль мультимера vWF заключается в обеспечении адгезии тромбоцитов к субэндотелиальному матриксу в условиях повреждения сосуда и гемодинамического стресса. Низкомолекулярные фрагменты vWF, циркулирующие в системном кровотоке, обладают слабой способностью к связыванию с тромбоцитами и не проявляют гемостатическую активность. В то время как аффинность отдельных субъединиц vWF к тромбоцитам чрезвычайно мала, мультимеры vWF обеспечивают одновременно множество участков связывания с рецепторами Ib-тромбоцитов, что позволяет значительно увеличить силу взаимодействия vWF-тромбоцитов. Так, аффинность высокомолекулярной формы vWF к тромбоцитам в 10 раз превышает таковую у отдельных субъединиц vWF [7]. Мультимерные «ленты» ULVWF могут фиксироваться на поверхности мембран эндотелиальных клеток при помощи Р-селектина, который секретируется из телец Weibel-Palade одновременно с ULVWF. В результате в условиях относительного или абсолютного дефицита ADAMTS-13 микрососуды перекрываются гигантскими ультравысокомолекулярными vWF, на которых оседает возрастающее количество тромбоцитов, образующих блокирующие микрососудистое русло тромбоцитарные тромбы. Одним из факторов, которые стимулируют выброс ULVWF из эндотелиальных клеток, являются провоспалительные цитокины.
Низкомолекулярные фрагменты vWF, циркулирующие в системном кровотоке, обладают слабой способностью к связыванию с тромбоцитами и не проявляют гемостатическую активность. В то время как аффинность отдельных субъединиц vWF к тромбоцитам чрезвычайно мала, мультимеры vWF обеспечивают одновременно множество участков связывания с рецепторами Ib-тромбоцитов, что позволяет значительно увеличить силу взаимодействия vWF-тромбоцитов. Так, аффинность высокомолекулярной формы vWF к тромбоцитам в 10 раз превышает таковую у отдельных субъединиц vWF [7]. Мультимерные «ленты» ULVWF могут фиксироваться на поверхности мембран эндотелиальных клеток при помощи Р-селектина, который секретируется из телец Weibel-Palade одновременно с ULVWF. В результате в условиях относительного или абсолютного дефицита ADAMTS-13 микрососуды перекрываются гигантскими ультравысокомолекулярными vWF, на которых оседает возрастающее количество тромбоцитов, образующих блокирующие микрососудистое русло тромбоцитарные тромбы. Одним из факторов, которые стимулируют выброс ULVWF из эндотелиальных клеток, являются провоспалительные цитокины. В связи с этим состояния, сопровождающиеся активацией процессов системного воспаления, в том числе такие осложнения беременности, как преэклампсия, могут стать стимулом к развитию тромботической микроангиопатии.
В связи с этим состояния, сопровождающиеся активацией процессов системного воспаления, в том числе такие осложнения беременности, как преэклампсия, могут стать стимулом к развитию тромботической микроангиопатии.
В норме у здоровых людей активность ADAMTS-13 варьирует в значительных пределах от 50 до 170%. Cнижение активности vWF-протеазы ниже нормы (менее 50%) наблюдается в течение третьего триместра беременности, при циррозе печени, диссеминированных опухолях и воспалительных заболеваниях. У пациентов, переживших ТТП, мультимерные комплексы vWF обнаруживаются лишь в острую фазу заболевания и не обнаруживаются в кровотоке после выздоровления. Возможно, при массивном повреждении эндотелия происходит значительный выброс vWF из гранул; при этом возникает относительная недостаточность металлопротеазы. Однако у пациентов, страдающих рецидивирующей формой ТТП, мультимеры vWF в кровотоке выявляются постоянно, как в острую фазу заболевания, так и в период ремиссии. Такая рецидивирующая форма заболевания чаще является наследственной и обусловлена отсутствием или дефицитом протеазы ADAMTS-13. Так, у большинства пациентов с семейной формой ТТП активность ADAMTS-13 в плазме крови составляет 5–10%, в то время как у большинства пациентов с приобретенной идиопатической ТТП подобное снижение активности ADAMTS-13 выявляется только в период рецидивов [8].
Так, у большинства пациентов с семейной формой ТТП активность ADAMTS-13 в плазме крови составляет 5–10%, в то время как у большинства пациентов с приобретенной идиопатической ТТП подобное снижение активности ADAMTS-13 выявляется только в период рецидивов [8].
В отличие от сериновых протеаз, у металлопротеазы vWF в норме не обнаруживается плазменный ингибитор. Если для большинства металлопротеаз период полужизни измеряется секундами и минутами, для vWF-протеазы этот показатель составляет 2–4 дня [9]. Поэтому у пациентов с рецидивирующей ТТП и наследственным дефектом vWF-протеазы при применении плазмы, содержащей vWF-протеазу, может быть достигнута ремиссия заболевания. При дефиците vWF, обусловленной наличием ингибитора, целью плазмафереза является удаление патогенных IgG; возможно также применение иммунносупрессивных препаратов (глюкортикоидов, винкристина). Ингибитор vWF-протеазы вновь появляется в крови через 3 месяца после лечения.
Антитела IgG к ADAMTS-13 выявляются у 44–94% пациентов с приобретенной формой ТТП [9].
Их уровень обычно возрастает в острый период или во время рецидива ТТП, тогда как в период ремиссии антитела к ADAMTS-13 в плазме крови у таких больных могут не выявляться. Постоянное обнаружение антител более характерно для больных с частыми рецидивами заболевания, для которых также характерно выявление выраженного дефицита ADAMTS-13. Причинами такого транзиторного выявления антител к ADAMTS-13 может быть, с одной стороны, недостаточная чувствительность доступных в настоящее время диагностических методик, а с другой стороны, дефекты иммунной регуляции, на фоне которых возможно возникновение интермиттирующего дефицита ADAMTS-13 под действием различных провоцирующих факторов (беременность, инфекционные заболевания).
Лабораторная диагностика тромботической микроангиопатии
Типичными лабораторными проявлениями ГУС/ТТП являются тромбоцитопения и гемолитическая анемия [10]. Характерно увеличение содержания лактатдегидрогеназы в сыворотке, что обусловлено активацией гемолиза, а также является признаком тканевой ишемии. Другими признаками гемолиза и перераздражения эритроцитарного ростка служат повышение билирубина (преимущественно непрямого), количества свободного гемоглобина и ретикулоцитов в периферической крови. Характерными признаками микроангиопатической природы гемолиза является обнаружение фрагментов эритроцитов – шистоцитов и отрицательная реакция Кумбса. Причиной образования шистоцитов является резкое сужение сосудов, создающее условия для гемодинамического стресса, обусловливающего фрагментацию эритроцитов. Диагностические подходы, используемые при тромботической микроангиопатии, описаны в табл. 2.
Другими признаками гемолиза и перераздражения эритроцитарного ростка служат повышение билирубина (преимущественно непрямого), количества свободного гемоглобина и ретикулоцитов в периферической крови. Характерными признаками микроангиопатической природы гемолиза является обнаружение фрагментов эритроцитов – шистоцитов и отрицательная реакция Кумбса. Причиной образования шистоцитов является резкое сужение сосудов, создающее условия для гемодинамического стресса, обусловливающего фрагментацию эритроцитов. Диагностические подходы, используемые при тромботической микроангиопатии, описаны в табл. 2.
Особенности тромботической микроангиопатии, ассоциированной с беременностью
Беременность по праву считается одним из важнейших триггерных факторов для развития ТТП. В 12–31% случаев ГУС/ТТП развивается во время беременности или в раннем послеродовом периоде [1, 10]. Заболеваемость ТТП во время беременности составляет 1 на 25–100 000 [1]. До внедрения в клиническую практику плазмафереза материнская смертность при ГУС/ТТП составляла 95%, а перинатальная – 80% [10]. Во время беременности наблюдается, с одной стороны, прогрессивное повышение уровня vWF, вероятно, под действием эстрогенов, а с другой, снижение активности ADAMTS-13, что может быть обусловлено повышенным потреблением этого фермента, действие которого направлено на разрушение избыточных количеств ультравысокомолекулярных мультимеров vWF, экспрессируемых активированным эндотелиоцитами. Таким образом, беременность может стать провоцирующим фактором для развития ТТП при генетическом дефекте ADAMTS-13. Кроме того, ТТП во время беременности встречалась и у пациенток с антителами к ADAMTS-13. Был описан интереснейший клинический случай: у 23-летней женщины в течение 73 месяцев было четыре беременности, заканчивавшиеся самопроизвольными абортами в первом триместре, после чего у нее развивались эпизоды ТТП, регрессировавшие на фоне лечения кортикостероидами и плазмаферезом. После имплантации противозачаточного средства новых эпизодов ТТП не отмечалось [11]. В настоящее время критериями для постановки диагноза из 5 характерных признаков этого заболевания служат только тромбоцитопения и микроангиопатическая гемолитическая анемия.
Во время беременности наблюдается, с одной стороны, прогрессивное повышение уровня vWF, вероятно, под действием эстрогенов, а с другой, снижение активности ADAMTS-13, что может быть обусловлено повышенным потреблением этого фермента, действие которого направлено на разрушение избыточных количеств ультравысокомолекулярных мультимеров vWF, экспрессируемых активированным эндотелиоцитами. Таким образом, беременность может стать провоцирующим фактором для развития ТТП при генетическом дефекте ADAMTS-13. Кроме того, ТТП во время беременности встречалась и у пациенток с антителами к ADAMTS-13. Был описан интереснейший клинический случай: у 23-летней женщины в течение 73 месяцев было четыре беременности, заканчивавшиеся самопроизвольными абортами в первом триместре, после чего у нее развивались эпизоды ТТП, регрессировавшие на фоне лечения кортикостероидами и плазмаферезом. После имплантации противозачаточного средства новых эпизодов ТТП не отмечалось [11]. В настоящее время критериями для постановки диагноза из 5 характерных признаков этого заболевания служат только тромбоцитопения и микроангиопатическая гемолитическая анемия. Клинически ТТП/ГУС в этом случае часто бывает трудно отличить от преэклампсии, эклампсии и HELLP-синдрома, для которых также характерно развитие тромоцитопении и микроангиопатической гемолитической анемии. Ситуация осложняется еще и тем, что HELLP-синдром и экламптические судороги могут развиваться и на фоне нормального артериального давления [12].
Клинически ТТП/ГУС в этом случае часто бывает трудно отличить от преэклампсии, эклампсии и HELLP-синдрома, для которых также характерно развитие тромоцитопении и микроангиопатической гемолитической анемии. Ситуация осложняется еще и тем, что HELLP-синдром и экламптические судороги могут развиваться и на фоне нормального артериального давления [12].
Таким образом, развитие тромботической микроангиопатии характерно для HELLP-синдрома, ТТП, ГУС, а также является одним из проявлений катастрофического АФС. Это свидетельствует о едином механизме патогенеза этих заболеваний. Рядом исследователей описаны случаи возникновения HELLP-синдрома у женщин с АФС, что лишний раз подтверждает роль патологии гемостаза как предрасполагающего фактора к возникновению HELLP-синдрома [13]. Следует также учитывать, что HELLP-синдром может быть первым проявлением АФС. Появились данные о роли антител к ADAMTS-13 в качестве причины тромбоцитопении у больных системной красной волчанкой, что может быть одним из критериев неблагоприятного прогноза заболевания у таких пациентов [14]. O. Pourrat и соавт. (2013) описывают взаимосвязь между дефицитом ADAMTS-13 и развитием HELLP-синдрома [15]. Более того, появились интересные данные о том, что антитела к ADAMTS-13 могут формироваться в условиях АФС, что может являться важнейшим фактором развития тромботических и акушерских осложнений [16]. Таким образом, антитела к ADAMTS-13 и дисфункция ADAMTS-13 могут развиваться и при других аутоиммунных заболеваниях, помимо приобретенной ТПП, в частности, в условиях АФС. В связи с этим мы считает, что у женщин с HELLP-синдромом необходим анализ на антифосфолипидные антитела и оценка активности ADAMTS-13 и наличия его ингибиторов.
O. Pourrat и соавт. (2013) описывают взаимосвязь между дефицитом ADAMTS-13 и развитием HELLP-синдрома [15]. Более того, появились интересные данные о том, что антитела к ADAMTS-13 могут формироваться в условиях АФС, что может являться важнейшим фактором развития тромботических и акушерских осложнений [16]. Таким образом, антитела к ADAMTS-13 и дисфункция ADAMTS-13 могут развиваться и при других аутоиммунных заболеваниях, помимо приобретенной ТПП, в частности, в условиях АФС. В связи с этим мы считает, что у женщин с HELLP-синдромом необходим анализ на антифосфолипидные антитела и оценка активности ADAMTS-13 и наличия его ингибиторов.
Принципы терапии ГУС/ТТП
Терапией выбора при ТТП/ГУС является применение свежезамороженной плазмы или плазмафереза. Применение обменного переливания плазмы позволяет снизить уровень смертности при ГУС/ТТП с 80 до 10%. Целью применения плазмафереза является возмещение уровня vWF-протеазы, удаление антител, блокирующих активность ADAMTS-13, провоспалительных цитокинов, компонентов комплемента из системного кровотока, а также возмещение дефицита естественных антикоагулянтов, что особенно важно при сочетании ТТП/ГУС с генетическими тромбофилиями и АФС. При наследственной форме, обусловленной гомозиготной или двумя гетерозиготными мутациями ADAMTS-13, эффективно применение свежезамороженной плазмы, а для профилактики рецидивов заболевания переливание плазмы необходимо применять раз в 2–3 недели [17]. У больных с приобретенной формой ТТП, у которых дефицит ADAMTS-13 в большинстве обусловлен не абсолютным отсутствием этого белка, а блокадой его активности вследствие циркуляции аутоантител, только переливания свежезамороженной плазмы может оказаться недостаточно, так как имеющиеся антитела будут блокировать и вновь поступающее в организм количество ADAMTS-13. Тем не менее, инфузия свежезамороженной плазмы у больных с приобретенной формой ТТП должна быть начата сразу после появления подозрения на ТТП при отсутствии возможности начать плазмаферез в экстренном порядке или до того, как будет уточнен диагноз [18].
При наследственной форме, обусловленной гомозиготной или двумя гетерозиготными мутациями ADAMTS-13, эффективно применение свежезамороженной плазмы, а для профилактики рецидивов заболевания переливание плазмы необходимо применять раз в 2–3 недели [17]. У больных с приобретенной формой ТТП, у которых дефицит ADAMTS-13 в большинстве обусловлен не абсолютным отсутствием этого белка, а блокадой его активности вследствие циркуляции аутоантител, только переливания свежезамороженной плазмы может оказаться недостаточно, так как имеющиеся антитела будут блокировать и вновь поступающее в организм количество ADAMTS-13. Тем не менее, инфузия свежезамороженной плазмы у больных с приобретенной формой ТТП должна быть начата сразу после появления подозрения на ТТП при отсутствии возможности начать плазмаферез в экстренном порядке или до того, как будет уточнен диагноз [18].
Помимо терапии плазмой, применяется целый ряд методов и лекарственных препаратов, однако эффективность большинства их них не доказана (табл. 3). Эти методы направлены на подавление синтеза аутоантител и применяются у больных с приобретенной ТТП и аутоантителами к ADAMTS-13 при отсутствии эффекта от стандартной терапии с применением плазмафереза и свежезамороженной плазмы. Возможные варианты терапии включают высокие дозы глюкокортикоидов, ритуксимаб (моноклональное антитела к CD20 на В-лимоцитах), в комбинации с циклофосфамидом, циклоспорином, спленэктомией. Так, появились данные о повышении эффективности терапии приобретенной ТТП при одновременном применении плазмафереза и глюкокортикоидов [19]. Рекомендуют начинать преднизолон внутривенно в дозе 200 мг в день сразу же после установления диагноза ТТП и продолжать лечение с постепенным снижением дозы вплоть до выздоровления [20].
3). Эти методы направлены на подавление синтеза аутоантител и применяются у больных с приобретенной ТТП и аутоантителами к ADAMTS-13 при отсутствии эффекта от стандартной терапии с применением плазмафереза и свежезамороженной плазмы. Возможные варианты терапии включают высокие дозы глюкокортикоидов, ритуксимаб (моноклональное антитела к CD20 на В-лимоцитах), в комбинации с циклофосфамидом, циклоспорином, спленэктомией. Так, появились данные о повышении эффективности терапии приобретенной ТТП при одновременном применении плазмафереза и глюкокортикоидов [19]. Рекомендуют начинать преднизолон внутривенно в дозе 200 мг в день сразу же после установления диагноза ТТП и продолжать лечение с постепенным снижением дозы вплоть до выздоровления [20].
Применение глюкокортикоидов до и после родов способствует уменьшению тяжести HELLP-синдрома, потребности в гемотрансфузии и позволяет продлить беременность на 24–48 ч, что важно для профилактики респираторного дистресс-синдрома новорожденных [21]. Предполагается, что применение глюкокортикоидов может способствовать восстановлению функций эндотелия, блокаде аутоиммунных патогенетических механизмов, предотвращать внутрисосудистое разрушение эритроцитов и тромбоцитов и прогрессирование системного воспалительного ответа. В частности, рассматривая HELLP-синдром как вариант приобретенной тромботической микроангиопатии, эффективность глюкокортикоидов можно объяснить блокирующим эффектом в отношении антител к ADAMTS-13 и антифосфолипидных антител. Однако вслед за улучшением клинической картины, отмечаемым в течение 24–48 ч на фоне применения глюкокортикоидов, может возникнуть так называемый «ребаунд»-феномен, проявляющийся ухудшением состояния беременной. Таким образом, введение глюкокортикоидов не предотвращает полностью развитие патологического процесса, а лишь кратковременно улучшает клиническую картину, создавая условия для более успешного родоразрешения.
Предполагается, что применение глюкокортикоидов может способствовать восстановлению функций эндотелия, блокаде аутоиммунных патогенетических механизмов, предотвращать внутрисосудистое разрушение эритроцитов и тромбоцитов и прогрессирование системного воспалительного ответа. В частности, рассматривая HELLP-синдром как вариант приобретенной тромботической микроангиопатии, эффективность глюкокортикоидов можно объяснить блокирующим эффектом в отношении антител к ADAMTS-13 и антифосфолипидных антител. Однако вслед за улучшением клинической картины, отмечаемым в течение 24–48 ч на фоне применения глюкокортикоидов, может возникнуть так называемый «ребаунд»-феномен, проявляющийся ухудшением состояния беременной. Таким образом, введение глюкокортикоидов не предотвращает полностью развитие патологического процесса, а лишь кратковременно улучшает клиническую картину, создавая условия для более успешного родоразрешения.
Важно отметить, что всем пациентам с ТТП, несмотря на выраженную тромбоцитопению, необходимо проведение тромбопрофилактики низкомолекулярным гепарином. Несмотря на выраженную тробоцитопению, переливание тромбоцитов показано только у пациентов с угрожающими жизни кровотечениями, так как это может спровоцировать прогрессирование тромботической микроангиопатии.
Несмотря на выраженную тробоцитопению, переливание тромбоцитов показано только у пациентов с угрожающими жизни кровотечениями, так как это может спровоцировать прогрессирование тромботической микроангиопатии.
Заключение
Открытия последних лет, связанные с изучением молекулярных механизмов тромботический микроангиопатии, позволяют сделать вывод, что эта патология гораздо более распространена, чем было принято считать ранее. Важнейшим триггером к развитию как ТТП, так и других вариантов тромботической микроангиопатии является беременность. Причинами тому могут быть физиологическое повышение уровня фактора фон Виллебранда, характерное для беременности, активное потребление и истощение запасов ADAMTS-13, что может усугублять ранее скрытый, умеренный генетически обусловленный дефицит этого фермента. Кроме того, последние данные указывают на взаимосвязь между циркуляцией антифосфолипидных антител и приобретенным дефицитом ADAMTS-13. В частности, такие механизмы могут играть важную роль в патогенезе тяжелых плацентарных осложнений беременности, в том числе преэклампсии, HELLP-синдрома. В настоящее время критерии для установления диагноза тромботической микроангиопатии значительно расширены. Эту патологию следует исключать у всех пациентов, у которых выявляется тромбоцитопения в сочетании с гемолитической анемией. Своевременная диагностика тромботической микроангиопатии имеет колоссальное значение для выбора тактики лечения, в том числе может полностью изменить подход к терапии пациенток с преэклампсией и HELLP-синдромом. Возможно, более глубокое изучение патогенеза тромботической микроангиопатии позволит разработать более чувствительные и специфичные методы диагностики этого патологического процесса и разработать эффективные методы его терапии.
В настоящее время критерии для установления диагноза тромботической микроангиопатии значительно расширены. Эту патологию следует исключать у всех пациентов, у которых выявляется тромбоцитопения в сочетании с гемолитической анемией. Своевременная диагностика тромботической микроангиопатии имеет колоссальное значение для выбора тактики лечения, в том числе может полностью изменить подход к терапии пациенток с преэклампсией и HELLP-синдромом. Возможно, более глубокое изучение патогенеза тромботической микроангиопатии позволит разработать более чувствительные и специфичные методы диагностики этого патологического процесса и разработать эффективные методы его терапии.
Макацария Александр Давидович, д.м.н., проф., член-корр. РАМН, зав. кафедрой акушерства и гинекологии медико-профилактического факультета 1-го МГМУ им. И.М. Сеченова. Адрес: 109004, Россия, Москва, ул. Земляной вал, д. 62, стр. 1. Телефон: 8 (903) 728-80-97. E-mail: [email protected]
Акиньшина Светлана Владимировна, к. м.н., научный сотрудник кафедры акушерства и гинекологии медико-профилактического факультета 1-го МГМУ им. И.М. Сеченова. Адрес: 109004, Россия, Москва, ул. Земляной вал, д. 62, стр. 1. Телефон: 8 (903) 238-80-48. E-mail: [email protected]
м.н., научный сотрудник кафедры акушерства и гинекологии медико-профилактического факультета 1-го МГМУ им. И.М. Сеченова. Адрес: 109004, Россия, Москва, ул. Земляной вал, д. 62, стр. 1. Телефон: 8 (903) 238-80-48. E-mail: [email protected]
Бицадзе Виктория Омаровна, проф. кафедры акушерства и гинекологии медико-профилактического факультета 1-го МГМУ им. И.М. Сеченова. Адрес: 109004, Россия, Москва, ул. Земляной вал, д. 62, стр. 1. Телефон: 8 (926) 231-38-29. E-mail: [email protected]
HELLP-синдром: современный взгляд на проблему
HEALTH OF WOMAN. 2019.2(138): 37–41; doi 10.15574/HW.2019.138.37
Жабицкая Л. А.
Национальный медицинский университет им. А.А. Богомольца, г. Киев
В статье представлен комплексный анализ современных данных про тяжелое осложнение беременности – HELLP-синдром. Изложены новые данные о распространенности, факторах риска возникновения данной патологии и патогенеза, описаны клинические симптомы и критерии диагностики. Проведенная систематизация результатов последних исследований позволила сформулировать особенности дифференциальной диагностики HELLP-синдрома с так называемыми имитаторами данной патологии. Согласно последним рекомендациям FIGO и основным клиническим гайдлайнам, приведены основные принципы ведения беременных с HELLP-синдромом. Также выделены рекомендации по переливанию тромбоцитов (с/без других продуктов крови), основанные на количественном показателе тромбоцитов, способе родоразрешения, наличия активного кровотечения и коагулопатии.
Проведенная систематизация результатов последних исследований позволила сформулировать особенности дифференциальной диагностики HELLP-синдрома с так называемыми имитаторами данной патологии. Согласно последним рекомендациям FIGO и основным клиническим гайдлайнам, приведены основные принципы ведения беременных с HELLP-синдромом. Также выделены рекомендации по переливанию тромбоцитов (с/без других продуктов крови), основанные на количественном показателе тромбоцитов, способе родоразрешения, наличия активного кровотечения и коагулопатии.
Ключевые слова: HELLP-синдром, критерии диагностики, терапия.
СПИСОК ЛИТЕРАТУРЫ
1. Венцківська І.Б., Жабіцька Л.А., Загородня О.С. та ін. (2017). Екстремальні стани в акушерстві та гінекології. К.: РА-ГАРМОНІЯ. 166.
2. Abildgaard U, Heimdal K. Pathogenesis of the syndrome of hemolysis, elevated liver enzymes, and low platelet count (HELLP): a review. Eur J Obstet Gynecol Reprod Biol 2013; 166:117. https://doi.org/10.1016/j.ejogrb.2012.09.026
https://doi.org/10.1016/j.ejogrb.2012.09.026
3. American College of Obstetricians and Gynecologists, Task Force on Hypertension in Pregnancy. Hypertension in pregnancy. Report of the American College of Obstetricians and Gynecologists’ Task Force on Hypertension in Pregnancy. Obstet Gynecol 2013 Nov;122(5):1122–1131.
4. Baha M Sibai, MD.HELLP syndrome. Sep 2017.
5. Burke SD, Zsengellér ZK, Khankin EV, et al. Soluble fms-like tyrosine kinase 1 promotes angiotensin II sensitivity in preeclampsia. J Clin Invest 2016; 126:2561. https://doi.org/10.1172/JCI83918
6. Chappell LC, Enye S, Seed P, Briley AL, Poston L, Shennan AH. Adverse perinatal outcomes and risk factors for preeclampsia in women with chronic hypertension: a prospective study. Hypertension 2008 Apr;51(4):1002–9. https://doi.org/10.1161/HYPERTENSIONAHA.107.107565
7. Committee on Obstetric Practice. Committee Opinion No. 623: Emergent therapy for acute-onset, severe hypertension during pregnancy and the postpartum period. Obstet Gynecol 2015 Feb;125(2): 521–525. https://doi.org/10.1097/01.AOG.0000460762.59152.d7
623: Emergent therapy for acute-onset, severe hypertension during pregnancy and the postpartum period. Obstet Gynecol 2015 Feb;125(2): 521–525. https://doi.org/10.1097/01.AOG.0000460762.59152.d7
8. Errol R Norwitz, MD, PhD, MBAJohn T Repke, MD. Preeclampsia: Management and prognosis. Aug 03, 2017.
9. Estcourt LJ, Ingram C, Doree C, et al. Use of platelet transfusions prior to lumbar punctures or epidural anaesthesia for the prevention of complications in people with thrombocytopenia. Cochrane Database Syst Rev 2016; :CD011980. https://doi.org/10.1002/14651858.CD011980.pub2
10. Gordon A, Raynes-Greenow C, Bond D, et al. Sleep position, fetal growth restriction, and late-pregnancy stillbirth: the Sydney stillbirth study. Obstet Gynecol 2015; 125:347. https://doi.org/10.1097/AOG.0000000000000627
11. Gradman AH, Basile JN, Carter BL, Bakris GL, American Society of Hypertension Writing Group. Combination therapy in hypertension. J Am Soc Hypertens 2010 Jan-Feb;4(1):42–50. https://doi.org/10.1016/j.jash.2010.02.005
J Am Soc Hypertens 2010 Jan-Feb;4(1):42–50. https://doi.org/10.1016/j.jash.2010.02.005
12. Lowe SA, Bowyer L, Lust K, McMahon LP, Morton MR, North RA, et al. The SOMANZ guideline for the management of hypertensive disorders of pregnancy. Sydney: SOMANZ; 2014. https://doi.org/10.1111/ajo.12253
13. Minakami H, Morikawa M, Yamada T, et al. Differentiation of acute fatty liver of pregnancy from syndrome of hemolysis, elevated liver enzymes and low platelet counts. J Obstet Gynaecol Res 2014; 40:641. https://doi.org/10.1111/jog.12282
14. National Collaborating Centre for Women’s and Children’s Health (UK). CG107: Hypertension in pregnancy: The management of hypertensive disorders during pregnancy. NICE: Guidance 2010 Aug; 2010 Aug.
15. National Institutes of Health. Drugs and Lactation Database (LactMed). 2015; Available at: http://toxnet.nlm.nih.gov/newtoxnet/lactmed.htm. Accessed March 16, 2015.
16. Roberts JM, August PA, Bakris G, Barton JR, Bernstin IM. The American College of Obstetricians and Gynecologists’ Task Force on Hypertension in Pregnancy. Hypertension in Pregnancy. Obstetrics & Gynecology 2013;122(5):1122–1131.
Roberts JM, August PA, Bakris G, Barton JR, Bernstin IM. The American College of Obstetricians and Gynecologists’ Task Force on Hypertension in Pregnancy. Hypertension in Pregnancy. Obstetrics & Gynecology 2013;122(5):1122–1131.
17. Seal SL, Ghosh D, Kamilya G, et al. Does route of delivery affect maternal and perinatal outcome in women with eclampsia? A randomized controlled pilot study. Am J Obstet Gynecol 2012; 206:484.e1. https://doi.org/10.1016/j.ajog.2012.04.009
18. The Figo Textbook of Pregnancy Hypertension. An evidence-based guide to monitoring, prevention and management. 2016. 456p.
19. van Dijk M, Thulluru HK, Mulders J, et al. HELLP babies link a novel lincRNA to the trophoblast cell cycle. J Clin Invest 2012; 122:4003. https://doi.org/10.1172/JCI65171
20. World Health Organization. WHO recommendations for prevention and treatment of pre-eclampsia and eclampsia. Geneva: WHO; 2011.
21. Zeisler H, Llurba E, Chantraine F, et al. Predictive Value of the sFlt-1:PlGF Ratio in Women with Suspected Preeclampsia. N Engl J Med 2016; 374:13. https://doi.org/10.1056/NEJMoa1414838
Zeisler H, Llurba E, Chantraine F, et al. Predictive Value of the sFlt-1:PlGF Ratio in Women with Suspected Preeclampsia. N Engl J Med 2016; 374:13. https://doi.org/10.1056/NEJMoa1414838
HELLP-синдром: Медицинская энциклопедия MedlinePlus
URL этой страницы: //medlineplus.gov/ency/article/000890.htm
Чтобы использовать функции обмена на этой странице, включите JavaScript.
HELLP-синдром представляет собой группу симптомов, возникающих у беременных женщин, у которых имеется:
- H: гемолиз (распад эритроцитов)
- EL: повышенный уровень ферментов печени
- LP: низкий уровень тромбоцитов
Причина HELLP-синдрома не установлена. Считается вариантом преэклампсии. Иногда наличие HELLP-синдрома связано с основным заболеванием, таким как антифосфолипидный синдром.
HELLP-синдром возникает примерно в 1–2 случаях из 1000 беременностей. У женщин с преэклампсией или эклампсией это состояние развивается в 10-20% случаев беременности.
У женщин с преэклампсией или эклампсией это состояние развивается в 10-20% случаев беременности.
Факторы риска HELLP-синдрома включают:
- Возраст старше 35 лет
- Ожирение
- Преэклампсия в анамнезе
- Диабет или заболевание почек в анамнезе
- Многоплодие в анамнезе
- Высокое артериальное давление в анамнезе
Чаще всего HELLP развивается в третьем триместре беременности (между 26–40 неделями гестации). Иногда он развивается через неделю после рождения ребенка.
Многие женщины имеют высокое кровяное давление, и у них диагностируют преэклампсию до того, как у них разовьется HELLP-синдром. В некоторых случаях симптомы HELLP являются первым предупреждением о преэклампсии. Состояние иногда неправильно диагностируется как:
- Flu or other viral illness
- Gallbladder disease
- Hepatitis
- Idiopathic thrombocytopenic purpura (ITP)
- Lupus flare
- Thrombotic thrombocytopenic purpura
Symptoms include:
- Fatigue or feeling unwell
- Fluid retention and избыточная прибавка в весе
- Головная боль
- Тошнота и рвота, которые продолжают усиливаться
- Боль в верхней правой или средней части живота
- Затуманенное зрение
- Кровотечение из носа или другое кровотечение, которое трудно остановить (редко)
- Судороги или судороги (редко)
правая верхняя сторона
Функциональные пробы печени (ферменты печени) могут быть высокими. Количество тромбоцитов может быть низким. Компьютерная томография может показать кровотечение в печень. Избыток белка может быть обнаружен в моче.
Количество тромбоцитов может быть низким. Компьютерная томография может показать кровотечение в печень. Избыток белка может быть обнаружен в моче.
Будут проведены анализы здоровья ребенка. Тесты включают, среди прочего, нестрессовый тест плода и ультразвуковое исследование.
Основным методом лечения является скорейшее рождение ребенка, даже если он недоношенный. Проблемы с печенью и другие осложнения HELLP-синдрома могут быстро ухудшиться и нанести вред как матери, так и ребенку.
Ваш врач может вызвать роды, дав вам лекарства для начала родов, или может выполнить кесарево сечение.
Вы также можете получить:
- Переливание крови, если проблемы с кровотечением становятся тяжелыми
- Кортикостероидные препараты, помогающие легким ребенка развиваться быстрее диагностируется рано. Очень важно регулярно проходить предродовые осмотры. Вы также должны немедленно сообщить своему врачу, если у вас есть симптомы этого заболевания.
Если это состояние не лечить на ранней стадии, у 1 из 4 женщин развиваются серьезные осложнения.
 Без лечения небольшое количество женщин умирает.
Без лечения небольшое количество женщин умирает.Смертность среди детей, рожденных матерями с HELLP-синдромом, зависит от массы тела при рождении и развития органов ребенка, особенно легких. Многие дети рождаются преждевременно (до 37 недель беременности).
HELLP-синдром может вернуться до 1 из 4 будущих беременностей.
Возможны осложнения до и после рождения ребенка, в том числе:
- Диссеминированное внутрисосудистое свертывание крови (ДВС-синдром). Нарушение свертываемости крови, которое приводит к избыточному кровотечению (кровоизлияниям).
- Жидкость в легких (отек легких)
- Почечная недостаточность
- Кровоизлияние и недостаточность печени
- Отделение плаценты от стенки матки (отслойка плаценты)
- Судороги
- Осложнения, в том числе задержка роста плода
0
После рождения ребенка синдром HELLP в большинстве случаев проходит.
Если симптомы HELLP-синдрома возникают во время беременности:
- Немедленно обратитесь к врачу.

- Позвоните по местному номеру службы экстренной помощи (например, 911).
- Доберитесь до отделения неотложной помощи больницы или родильного отделения.
Неизвестно, как предотвратить HELLP-синдром. Все беременные женщины должны своевременно начинать дородовой уход и продолжать его в течение всей беременности. Это позволяет поставщику услуг сразу выявлять и лечить такие состояния, как HELLP-синдром.
- Преэклампсия
Мехра С., Рейнус Дж. Ф. Желудочно-кишечные и печеночные расстройства у беременной. В: Фельдман М., Фридман Л.С., Брандт Л.Дж., ред. Болезни желудочно-кишечного тракта и печени Слейзенгера и Фордтрана. 11-е изд. Филадельфия, Пенсильвания: Elsevier; 2021: глава 40.
Сибай БМ. Преэклампсия и гипертонические расстройства. В: Landon MB, Galan HL, Jauniaux ERM, et al, eds. Акушерство Габбе: нормальная и проблемная беременность. 8-е изд. Филадельфия, Пенсильвания: Elsevier; 2021: глава 38.
Обновлено: ЛаКуита Мартинес, доктор медицинских наук, отделение акушерства и гинекологии, больница Эмори Джонс Крик, Альфаретта, Джорджия.
 Также рассмотрены Дэвидом Зивом, доктором медицины, MHA, медицинским директором, Брендой Конауэй, редакционным директором, и A.D.A.M. Редакционная коллегия.
Также рассмотрены Дэвидом Зивом, доктором медицины, MHA, медицинским директором, Брендой Конауэй, редакционным директором, и A.D.A.M. Редакционная коллегия.HELLP-синдром — StatPearls — NCBI Bookshelf
Continuing Education Activity
Синдром гемолиза с микроангиопатическим мазком крови, повышенным уровнем ферментов печени и низким количеством тромбоцитов более известен под аббревиатурой HELLP-синдром у беременных и родильниц. Это может быть осложнением или прогрессированием тяжелой преэклампсии; однако эта взаимосвязь была поставлена под сомнение недавними данными о том, что эти патологии могут иметь разную этиологию. В этом упражнении рассматриваются этиология, клиническая картина, оценка, дифференциальная диагностика и лечение HELLP-синдрома.
Цели:
Определите факторы риска развития HELLP-синдрома.
Распознайте клиническую картину пациента с HELLP-синдромом и просмотрите результаты диагностического обследования.

Опишите лечение синдрома HELLP.
Подчеркните важность сотрудничества между специалистами разных специальностей для улучшения материнских и неонатальных исходов у пациентов с HELLP-синдромом.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Синдром гемолиза с микроангиопатическим мазком крови, повышенным уровнем ферментов печени и низким уровнем тромбоцитов у беременных и родильниц более известен под аббревиатурой HELLP-синдром.[1][2] Это может быть осложнением или прогрессированием тяжелой преэклампсии; однако эта взаимосвязь была поставлена под сомнение недавними данными о том, что они могут быть отдельными расстройствами, поскольку предшествующая гипертензия или протеинурия отсутствуют по крайней мере у 15–20 % пациентов с синдромом HELLP.[3] Наличие в анамнезе преэклампсии или HELLP-синдрома может привести к рецидиву при последующих беременностях.
 [3]
[3]Многоплодие и возраст могут способствовать повышенному риску.[3][4][5] Отмечена генетическая связь повышенной предрасположенности к HELLP-синдрому.[3] Недавно сообщалось, что пациентки с инфекцией SARS-CoV-2 во время беременности имеют повышенный риск развития преэклампсии и HELLP-синдрома.[6]
Этиология
Этиология синдрома HELLP неясна, но считается, что это системное воспалительное заболевание, опосредованное каскадом комплемента.[5][7] Предполагается, что может иметь место совпадение с аналогичным патогенезом, как при преэклампсии с плохой плацентацией, но по неизвестным причинам это может привести к преувеличенной активации системы комплемента и большему воспалению печени у пациентов с HELLP-синдромом. Подмножество HELLP-синдрома вызвано нарушением регуляции комплемента, связанным с тромботической микроангиопатией, и может проявляться гемолитико-уремическим синдромом (ГУС), связанным с беременностью [8]. Дефицит длинноцепочечной 3-гидроксиацил-КоА-дегидрогеназы плода (LCHAD) может способствовать патогенезу HELLP-синдрома, но оценка этих генетических вариантов не требуется, поскольку их роль в клиническом ведении не определена [9].
 ]
]Эпидемиология
Синдром HELLP имеет распространенность от 0,5% до 0,9%. Около 70% случаев приходится на третий триместр беременности, а остальные — в течение 48 часов после родов.[10] Смертность женщин с HELLP-синдромом составляет от 0 до 24%, при этом перинатальная смертность достигает 37%.[5][11]
Патофизиология
Ишемически-реперфузионное повреждение запускает системный воспалительный процесс при синдроме HELLP. Спиральные артерии, которые не реконструируются из-за неадекватной инвазии трофобласта или дефектного эндотелиального апоптоза, приводят к ишемии плаценты. Это вызывает активацию эндотелия, что сопровождается повышенным выбросом антиангиогенных факторов, что приводит к полиорганному микрососудистому поражению. Кроме того, аномальное окисление жирных кислот плодом и высвобождение метаболических промежуточных продуктов в кровоток матери вызывает дисфункцию печени и сосудов. Это происходит, когда плод имеет наследственный дефект митохондриального окисления жирных кислот.
 Воспалительный компонент включает увеличение количества лейкоцитов и провоспалительных цитокинов при снижении уровня противовоспалительных цитокинов.[1][7][12]
Воспалительный компонент включает увеличение количества лейкоцитов и провоспалительных цитокинов при снижении уровня противовоспалительных цитокинов.[1][7][12]Коагуляционный каскад активируется адгезией тромбоцитов на активированном и поврежденном эндотелии. Тромбоциты выделяют тромбоксан А и серотонин, вызывая спазм сосудов, агрегацию тромбоцитов и дальнейшее повреждение эндотелия. Это вызывает использование тромбоцитов и, следовательно, тромбоцитопению. Эритроциты разрушаются при прохождении через эти богатые тромбоцитами и фибрином капилляры, вызывая микроангиопатическую гемолитическую анемию. Полиорганное микрососудистое повреждение и некроз печени приводят к развитию HELLP-синдрома. Каскад заканчивается рождением плода.[1]
Гистопатология
Наличие шистоцитов или шлемовидных клеток в мазке периферической крови является диагностическим признаком микроангиопатической гемолитической анемии. Гистология печени показывает жировую инфильтрацию, внутрисосудистые отложения фибрина, нейтрофильный инфильтрат, синусоидальную обструкцию, застой внутрипеченочных сосудов, некроз печени и перипортальное кровоизлияние.
 В конечном итоге это может привести к интрапаренхиматозному или субкапсулярному кровоизлиянию и разрыву капсулы [13].
В конечном итоге это может привести к интрапаренхиматозному или субкапсулярному кровоизлиянию и разрыву капсулы [13].Исторический и физический
Пациентки обычно повторнородящие и старше 35 лет. Пациенты обычно обращаются в период от 28 до 37 недель беременности (третий триместр) или сразу после родов в течение семи дней после родов. Клиническая картина у пациентов с HELLP-синдромом может быть различной. Они могут проявляться коликообразной болью в середине эпигастрия и/или правом подреберье, сопровождающейся тошнотой, рвотой и утомляемостью. Сопутствующие признаки могут включать желтуху, увеличение обхвата живота, отек ног, головную боль и изменения зрения. У пациентов могут наблюдаться сильное кровотечение, отслойка плаценты, острая почечная недостаточность, гематома печени или отслойка сетчатки.
При физикальном обследовании у пациентов выявляется артериальная гипертензия с артериальным давлением >140/90 мм рт.ст. и может быть асцит или отек стопы. Отмечается болезненность в правом подреберье или эпигастрии.
 Иктеричность может присутствовать. Возможны нарушения зрения. При подозрении на любое из вышеперечисленных осложнений следует провести соответствующий медицинский осмотр.[14]
Иктеричность может присутствовать. Возможны нарушения зрения. При подозрении на любое из вышеперечисленных осложнений следует провести соответствующий медицинский осмотр.[14]Оценка
Если у беременной пациентки в третьем триместре беременности или сразу после родов <7 дней после рождения проявляются вышеперечисленные симптомы HELLP-синдрома и отмечается впервые выявленная гипертензия или протеинурия, необходимы следующие лабораторные тесты для установления диагноз синдрома HELLP:
Полный счет крови
Периферический мазенок
Тесты функции печени: аспартат -аминотрансфераза (AST), аланин аминотрансфераза (ALT), билирубин
. повышены, определяют гаптоглобин, лактатдегидрогеназу (ЛДГ) и проводят исследования коагуляции, включая фибриноген, протромбин (ПВ) и активированное частичное тромбопластиновое время (ЧТВ). Классификация Теннесси используется для диагностики HELLP-синдрома и требует наличия всех трех критериев.
 [5]
[5]1) Гемолиз, подтвержденный не менее 2 результатов:
Периферический мазок с шистоцитами и клетками Burr
Сыворотка Bilirubin> 1,2 мг/DL
Low Serum aptoglobin (<25mg/dl) или DL) или DL) или DL) или DL) или DL) или DL) или DL) или DL)
6 (<25 мг/дл)
6. LDH>в два раза выше верхнего уровня нормы.
Тяжелая анемия с уровнем гемоглобина <8–10 г/дл в зависимости от срока беременности, не связанная с кровопотерей.
2) Повышенные ферменты печени: АСТ или АЛТ более чем в 2 раза превышают верхний уровень нормы.
3) Низкий уровень тромбоцитов: <100 000 клеток/мкл.
Классификация штата Миссисипи иногда используется для подклассификации пациентов с HELLP-синдромом.[5] Категории приведены в следующей таблице:
Таблица
Количество тромбоцитов (клеток/мкл)
Пациенты, отвечающие некоторым из вышеперечисленных критериев, считаются имеющими частичный HELLP-синдром и могут прогрессировать до соответствия всем критериям и следовательно, следует тщательно контролировать.

HELLP-синдром в основном включает активацию тромбоцитов без влияния на факторы свертывания крови, поэтому у пациентов будут нормальные показатели ПВ, АЧТВ и фибриногена. Диссеминированное внутрисосудистое свертывание (ДВС-синдром) может сосуществовать, если ПВ и АЧТВ удлиняются или если фибриноген низкий [15].
Лечение/управление
Медицинское управление в основном поддерживающее.[1][3][5] Этим пациентам может потребоваться поддержка вентилятора, вазопрессорная поддержка, обезболивание, мониторинг состояния объема и нутритивная поддержка. Поскольку состояние этих пациентов может быстро ухудшаться, их лучше всего лечить в центрах третичной медицинской помощи с соответствующими уровнями отделений интенсивной терапии для матерей и новорожденных. Следует рассмотреть вопрос о переводе их сразу после стабилизации состояния из больниц, где такая медицинская помощь не может быть оказана.
Первым шагом в ведении этих тяжелобольных пациенток является их стабилизация и оценка состояния плода с помощью нестрессового теста и ультразвукового исследования биофизического профиля.

Консультации реаниматолога, гепатолога, нефролога, гематолога, хирурга, гинеколога и неонатолога следует рассматривать как можно скорее для совместного лечения.
Пациентам с тяжелой артериальной гипертензией следует немедленно начать внутривенное введение лабеталола, гидралазин или нифедипина.
Пациенты с сильной болью в правом подреберье или эпигастрии и повышенными показателями функциональных проб печени должны быть немедленно обследованы с помощью ультразвукового исследования у постели больного, чтобы исключить разрыв печени, фульминантную печеночную недостаточность или печеночное кровотечение, и может потребоваться подтверждение с помощью компьютерной томографии (КТ) или магнитно-резонансная томография (МРТ) [16]. Хирургическое вмешательство, включая трансплантацию печени, может потребоваться, если есть признаки разрыва печени. Менее инвазивная чрескожная эмболизация печеночных артерий может быть рассмотрена у стабильных пациентов.
Лечение в основном поддерживающее у пациентов с ДВС-синдромом, отеком легких, острой дыхательной недостаточностью и острым повреждением почек и должно быть стабилизировано в соответствии с клиническими рекомендациями.

Могут потребоваться массивные переливания крови. Рассмотрите возможность переливания эритроцитарной массы пациентам, если уровень гемоглобина <7 г/дл или если у пациента имеются экхимозы, тяжелая гематурия или подозрение на отслойку плаценты. Всем активно кровоточащим пациентам с любой степенью тромбоцитопении следует переливать тромбоциты. Пациентам с сопутствующим ДВС-синдромом может потребоваться свежезамороженная плазма и криопреципитат.[15]
Пациентам с HELLP-синдромом и сопутствующей ТТП показан терапевтический плазмаферез.[17]
Пациенток следует немедленно направить к гинекологу для рассмотрения вопроса о скорейшем родоразрешении, поскольку это единственный эффективный метод лечения. Введение бетаметазона рекомендуется для достижения зрелости легких плода, когда пациентка поступает на сроке менее 34 недель беременности. Прием сульфата магния следует начинать во время госпитализации для предотвращения судорог у матери и нейропротекторного действия на плод/новорожденного.
 В двух крупных двойных слепых рандомизированных исследованиях не было доказано преимущества назначения дексаметазона у пациентов с HELLP-синдромом, поскольку он не улучшал материнские или перинатальные/младенческие исходы.[18][19]]
В двух крупных двойных слепых рандомизированных исследованиях не было доказано преимущества назначения дексаметазона у пациентов с HELLP-синдромом, поскольку он не улучшал материнские или перинатальные/младенческие исходы.[18][19]]Дифференциальный диагноз
HELLP-синдром следует дифференцировать от других нарушений беременности со схожими признаками.[1][20] Ниже приведены некоторые из важных дифференциальных диагнозов:
Преэклампсия с ДВС-синдромом: обычно у пациенток в 3-м триместре симптомы сходны с HELLP-синдромом. Преэклампсия с ДВС-синдромом Вовлекает факторы свертывания и вызывает увеличение ПВ и АЧТВ, в отличие от синдрома HELLP. Пациенты будут иметь гипертонию и протеинурию, как и у пациентов с синдромом HELLP.
Острая жировая дистрофия печени беременных (AFL): проявляется в третьем триместре, как и у пациентов с HELLP-синдромом. Эти пациенты в основном имеют обструктивный характер поражения печени. Прямой билирубин повышен, в отличие от пациентов с HELLP-синдромом.
 У этих больных повышен уровень аммиака. Присутствует гипогликемия, в отличие от синдрома HELLP.
У этих больных повышен уровень аммиака. Присутствует гипогликемия, в отличие от синдрома HELLP.Тромботическая тромбоцитопеническая пурпура (ТТП): пациенты в основном проявляются в первом триместре, в отличие от пациентов с синдромом HELLP. Они имеют характерную пентаду: лихорадка, измененный психический статус, острая почечная недостаточность/гематурия, гемолитическая анемия и тромбоцитопения. Факторы свертывания крови не изменяются (ПВ/ЧТВ в норме). Пациенты обычно нормотензивны без протеинурии. ADAMTS-13 имеет низкий уровень с повышенными мультимерами VWF.
Связанный с беременностью гемолитико-уремический синдром (ГУС) возникает вторично по отношению к врожденному синдрому, ведущему к активации комплемента, в отличие от традиционного ГУС, связанного с E.coli 0157:H7. У них картина, похожая на ТТП, но без лихорадки или ОГН. ADAMTS 13 не опускается. Они имеют увеличенные мультимеры WVF. Лечение этих пациентов – экулизумаб.
Обострение системной красной волчанки: у них могут быть тромбоцитопения и гемолитическая анемия.
 Функциональные пробы печени в норме, желтуха при волчанке отсутствует. Гипертензия и протеинурия могут присутствовать подобно HELLP-синдрому. У них есть другие типичные характеристики волчаночноподобной скуловой сыпи, плеврита, артрита и перикардиального выпота.
Функциональные пробы печени в норме, желтуха при волчанке отсутствует. Гипертензия и протеинурия могут присутствовать подобно HELLP-синдрому. У них есть другие типичные характеристики волчаночноподобной скуловой сыпи, плеврита, артрита и перикардиального выпота.Антифосфолипидный синдром (АФС): Могут наблюдаться гемолиз и тромбоцитопения. Функциональные пробы печени в норме. У них может быть гипертензия и протеинурия, как у пациентов с HELLP-синдромом. Доминирующими признаками АФС являются рецидивирующие артериальные/венозные тромбозы и повторные самопроизвольные аборты <10 недель гестации или потеря плода. Для диагностики необходим повышенный уровень волчаночного антикоагулянта, антител к кардиолипину и антител к бета2-гликопротеину [21].
Другое: Фульминантный Вирусный гепатит следует учитывать при дифференциальной диагностике. Соответствующее тестирование и сбор анамнеза позволят поставить диагноз.
Прогноз
Синдром HELLP представляет собой опасное для жизни состояние.
 Смертность женщин с HELLP-синдромом составляет 0-24%, перинатальная смертность достигает 37%.[11] Материнская смерть происходит из-за диссеминированного внутрисосудистого свертывания крови (ДВС-синдром), отслойки плаценты, послеродового кровотечения или острой почечной недостаточности. ДВС-синдром встречается в 15–62,5 % случаев. Отслойка плаценты происходит у 11–25 % женщин с синдромом HELLP. Послеродовое кровотечение возникает в 12,5-40% случаев, а острая почечная недостаточность — в 36-50% случаев. Плохой перинатальный прогноз обусловлен отслойкой плаценты, внутриутробной гипоксией, асфиксией, недоношенностью и низкой массой тела при рождении [22].
Смертность женщин с HELLP-синдромом составляет 0-24%, перинатальная смертность достигает 37%.[11] Материнская смерть происходит из-за диссеминированного внутрисосудистого свертывания крови (ДВС-синдром), отслойки плаценты, послеродового кровотечения или острой почечной недостаточности. ДВС-синдром встречается в 15–62,5 % случаев. Отслойка плаценты происходит у 11–25 % женщин с синдромом HELLP. Послеродовое кровотечение возникает в 12,5-40% случаев, а острая почечная недостаточность — в 36-50% случаев. Плохой перинатальный прогноз обусловлен отслойкой плаценты, внутриутробной гипоксией, асфиксией, недоношенностью и низкой массой тела при рождении [22].Пациенты с синдромом HELLP имеют риск развития синдрома HELLP от 19% до 27% при последующих беременностях. Рецидивирующие случаи возникают во второй половине периода беременности и становятся менее тяжелыми после двух эпизодов.[23]
Осложнения
Синдром HELLP представляет собой опасное для жизни состояние с высоким уровнем материнской и младенческой смертности.
 Материнские осложнения включают:
Материнские осложнения включают:Эклампсию
Отслойку плаценты
Cesarean section
DIC
Recurrent thrombosis
Liver rupture/hematoma
Fulminant liver failure
Cerebral infarction
Cerebral hemorrhage
Pulmonary/cerebral edema
Сердечно-сосудистая нестабильность
Острое повреждение почек
Инфекция/сепсис
Отряд сетчатки
Тяжелое перипартум кровотечение
Материнская гибель [24] [22]
.
Преждевременные роды
Неонатальная тромбоцитопения, лейкопения, нейтропения
Респираторный дистресс-синдром[22]
Intensive care
Anesthesiology
Pediatrics/neonatology
Maternal-fetal medicine
Hepatology
Surgery
Nephrology
Hematology
Офтальмология
Получите бесплатный доступ к вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
- 1.
Wallace K, Harris S, Addison A, Bean C. Синдром HELLP: патофизиология и современные методы лечения. Карр Фарм Биотехнолог. 2018;19(10):816-826. [PubMed: 29998801]
- 2.
Стоун Дж.Х. HELLP-синдром: гемолиз, повышенный уровень печеночных ферментов и низкий уровень тромбоцитов. ДЖАМА. 1998 12 августа; 280(6):559-62. [PubMed: 9707148]
- 3.
Фитцпатрик К.Е., Хиншоу К., Куринчук Дж.Дж., Найт М. Факторы риска, лечение и исходы гемолиза, повышенный уровень ферментов печени и синдром низкого уровня тромбоцитов и повышенный уровень ферментов печени, низкий уровень тромбоцитов синдром.
 Акушерство Гинекол. 2014 март; 123(3):618-627. [PubMed: 24499757]
Акушерство Гинекол. 2014 март; 123(3):618-627. [PubMed: 24499757]- 4.
Хаддад Б., Бартон Дж. Р., Ливингстон Дж. К., Чахин Р., Сибай Б. М. Факторы риска неблагоприятных материнских исходов у женщин с синдромом HELLP (гемолиз, повышенный уровень ферментов печени и низкий уровень тромбоцитов). Am J Obstet Gynecol. 2000 г., август; 183 (2): 444-8. [В паблике: 10942484]
- 5.
Haram K, Svendsen E, Abildgaard U. Синдром HELLP: клинические вопросы и лечение. Обзор. BMC Беременность Роды. 2009 26 февраля; 9:8. [Статья бесплатно PMC: PMC2654858] [PubMed: 19245695]
- 6.
Conde-Agudelo A, Romero R. Инфекция SARS-CoV-2 во время беременности и риск преэклампсии: систематический обзор и метаанализ. Am J Obstet Gynecol. 2022 янв; 226(1):68-89.e3. [Бесплатная статья PMC: PMC8294655] [PubMed: 34302772]
- 7.
Abildgaard U, Heimdal K. Патогенез синдрома гемолиза, повышенных ферментов печени и низкого количества тромбоцитов (HELLP): обзор.
 Eur J Obstet Gynecol Reprod Biol. 2013 февраль; 166(2):117-23. [PubMed: 23107053]
Eur J Obstet Gynecol Reprod Biol. 2013 февраль; 166(2):117-23. [PubMed: 23107053]- 8.
Бервик Р.М., Файнберг Б.Б. Экулизумаб для лечения преэклампсии/HELLP-синдрома. Плацента. 2013 фев; 34 (2): 201-3. [PubMed: 23228435]
- 9.
Цукер SD. ПОЛЕЗНО ли рассматривать висячий LCHAD при заболеваниях печени, связанных с беременностью? Гастроэнтерология. 2003 г., май; 124(5):1548-50; обсуждение 1550. [PubMed: 15534983]
- 10.
Киркпатрик СА. HELLP-синдром. Акта Клин Белг. 2010 март-апрель;65(2):91-7. [PubMed: 20491358]
- 11.
ван Лисхаут LCEW, Коек Г.Х., Спаандерман М.А., ван Раннард Хеймель П.Дж. Плацентарные факторы, участвующие в патогенезе печени при синдроме гемолиза, повышенных ферментах печени и низких тромбоцитах (HELLP): обзор. Беременность Гипертония. 2019 окт;18:42-48. [PubMed: 31494464]
- 12.
Стояновска В., Зенклуссен А.С. Врожденные и адаптивные иммунные ответы при синдроме HELLP.
 Фронт Иммунол. 2020;11:667. [Бесплатная статья PMC: PMC7174768] [PubMed: 32351511]
Фронт Иммунол. 2020;11:667. [Бесплатная статья PMC: PMC7174768] [PubMed: 32351511]- 13.
Dusse LM, Alpoim PN, Silva JT, Rios DR, Brandão AH, Cabral AC. Возвращаясь к HELLP-синдрому. Клин Чим Акта. 07 декабря 2015 г.; 451 (часть B): 117–20. [PubMed: 26525965]
- 14.
Jiang R, Wang T, Li B, He J. Клинические характеристики и исходы беременности при атипичном гемолизе, повышенном уровне ферментов печени и синдроме низкого уровня тромбоцитов: серия случаев. Медицина (Балтимор). 2020 май;99(18):e19798. [Бесплатная статья PMC: PMC7440217] [PubMed: 32358352]
- 15.
Эрез О., Отман М., Рабинович А., Лерон Э., Готч Ф., Тачил Дж. ДВС-синдром при беременности — патофизиология, клинические характеристики, диагностические показатели, и лечение. Дж. Кровь Мед. 2022;13:21-44. [Бесплатная статья PMC: PMC8747805] [PubMed: 35023983]
- 16.
McCormick PA, Higgins M, McCormick CA, Nolan N, Docherty JR.
 Инфаркт печени, гематома и разрыв при синдроме HELLP: поддержка вазоспастической гипотезы. J Matern Fetal Neonatal Med. 2021 15 июня;: 1-6. [В паблике: 34130599]
Инфаркт печени, гематома и разрыв при синдроме HELLP: поддержка вазоспастической гипотезы. J Matern Fetal Neonatal Med. 2021 15 июня;: 1-6. [В паблике: 34130599]- 17.
Факури Ф., Скалли М., Провот Ф., Бласко М., Коппо П., Норис М., Пайзис К., Кавана Д., Пене Ф., Кесада С., Хертиг А., Кисслинг С., О’Брайен П. , Delmas Y, Alberio L, Winer N, Veyradier A, Cataland S, Frémeaux-Bacchi V, Loirat C, Remuzzi G, Tsatsaris V. Лечение тромботической микроангиопатии во время беременности и после родов: отчет международной рабочей группы. Кровь. 2020 ноябрь 05;136(19):2103-2117. [PubMed: 32808006]
- 18.
Fonseca JE, Méndez F, Cataño C, Arias F. Лечение дексаметазоном не улучшает исходы у женщин с синдромом HELLP: двойное слепое, плацебо-контролируемое, рандомизированное клиническое исследование . Am J Obstet Gynecol. 2005 ноябрь; 193(5):1591-8. [PubMed: 16260197]
- 19.
Katz L, de Amorim MM, Figueiroa JN, Pinto e Silva JL.
 Послеродовой дексаметазон для женщин с гемолизом, повышенными ферментами печени и синдромом низкого уровня тромбоцитов (HELLP): двойное слепое, плацебо-контролируемое, рандомизированное клиническое исследование. Am J Obstet Gynecol. 2008 март; 198(3):283.e1-8. [PubMed: 18194800]
Послеродовой дексаметазон для женщин с гемолизом, повышенными ферментами печени и синдромом низкого уровня тромбоцитов (HELLP): двойное слепое, плацебо-контролируемое, рандомизированное клиническое исследование. Am J Obstet Gynecol. 2008 март; 198(3):283.e1-8. [PubMed: 18194800]- 20.
Сибай Б.М. Имитаторы тяжелой преэклампсии. Акушерство Гинекол. 2007 г., апрель; 109 (4): 956-66. [В паблике: 17400860]
- 21.
Рао Д., Чаудхари Н.К., Мур Р.М., Джим Б. HELLP-синдром: диагностическая головоломка с тяжелыми осложнениями. BMJ Case Rep. 2016, 17 августа 2016 г. [Статья PMC бесплатно: PMC5015173] [PubMed: 27535735]
- 22.
Садаф Н., Хак Г., Шукар-уд-Дин С. Исходы для матери и плода при синдроме HELLP в больница третичного уровня. J Pak Med Assoc. 2013 Декабрь; 63 (12): 1500-3. [PubMed: 24397093]
- 23.
Падден Миссури. Синдром HELLP: распознавание и перинатальное ведение. Ам семейный врач.

Consultations
Сдерживание и обучение пациентов
Пациентов с синдромом HELLP следует информировать о течении заболевания.
 Риск материнских и перинатальных осложнений и смертности должен быть разъяснен пациентке и ее семье. Риск развития HELLP при последующих беременностях можно снизить, если вести здоровый образ жизни и предотвращать такие заболевания, как гипертония и диабет. Следует соблюдать регулярные физические упражнения. Рутинный дородовой уход и лабораторные анализы должны быть начаты на ранних сроках последующих беременностей.
Риск материнских и перинатальных осложнений и смертности должен быть разъяснен пациентке и ее семье. Риск развития HELLP при последующих беременностях можно снизить, если вести здоровый образ жизни и предотвращать такие заболевания, как гипертония и диабет. Следует соблюдать регулярные физические упражнения. Рутинный дородовой уход и лабораторные анализы должны быть начаты на ранних сроках последующих беременностей.Улучшение результатов медицинского персонала
Ведение HELLP-синдрома, расстройства беременности, требует участия специалистов нескольких специальностей помимо акушера. Острые осложнения и поддерживающее лечение, включая контроль артериального давления, лечение отека легких и мониторинг состояния объема, могут контролироваться госпиталистом. Острая дыхательная недостаточность, требующая искусственной вентиляции легких, и шок, требующий прессорной терапии, могут совместно контролироваться госпиталистом и реаниматологом. Если пациенту требуется большой объем продуктов крови, в интересах пациента было бы привлечь к лечению гематолога.
 Нефролог может быть привлечен, если у пациента развивается острая почечная недостаточность. Привлечение гепатолога и хирургической бригады необходимо, если у пациента развиваются такие осложнения, как гематома или разрыв печени. Вмешательство офтальмолога может быть необходимо, если у пациента развиваются какие-либо изменения зрения. Неонатолог может быть привлечен на раннем этапе, чтобы избежать неонатальных осложнений.
Нефролог может быть привлечен, если у пациента развивается острая почечная недостаточность. Привлечение гепатолога и хирургической бригады необходимо, если у пациента развиваются такие осложнения, как гематома или разрыв печени. Вмешательство офтальмолога может быть необходимо, если у пациента развиваются какие-либо изменения зрения. Неонатолог может быть привлечен на раннем этапе, чтобы избежать неонатальных осложнений.Управление синдромом HELLP также требует управления межпрофессиональной командой. В дополнение к вышеперечисленным клиницистам (включая врачей, а также практикующих врачей среднего звена, т. Е. NP и PA), средний медицинский персонал и фармацевты могут внести значительный вклад в уход за пациентами. Сестринский уход окажет поддержку при оценке и хирургических вмешательствах, а фармацевт выполнит согласование лекарств для лекарств, необходимых в рамках лечения или после операции. Все члены межпрофессиональной бригады должны заменить остальную часть бригады, если есть какие-либо изменения в клиническом статусе, и задокументировать свои выводы в истории болезни пациента.
 Этот межпрофессиональный командный подход поможет добиться положительных результатов лечения пациентов с HELLP-синдромом. [Уровень 5]
Этот межпрофессиональный командный подход поможет добиться положительных результатов лечения пациентов с HELLP-синдромом. [Уровень 5]Контрольные вопросы
Ссылки

 Без лечения небольшое количество женщин умирает.
Без лечения небольшое количество женщин умирает.
 Также рассмотрены Дэвидом Зивом, доктором медицины, MHA, медицинским директором, Брендой Конауэй, редакционным директором, и A.D.A.M. Редакционная коллегия.
Также рассмотрены Дэвидом Зивом, доктором медицины, MHA, медицинским директором, Брендой Конауэй, редакционным директором, и A.D.A.M. Редакционная коллегия.
 [3]
[3] ]
] Воспалительный компонент включает увеличение количества лейкоцитов и провоспалительных цитокинов при снижении уровня противовоспалительных цитокинов.[1][7][12]
Воспалительный компонент включает увеличение количества лейкоцитов и провоспалительных цитокинов при снижении уровня противовоспалительных цитокинов.[1][7][12] В конечном итоге это может привести к интрапаренхиматозному или субкапсулярному кровоизлиянию и разрыву капсулы [13].
В конечном итоге это может привести к интрапаренхиматозному или субкапсулярному кровоизлиянию и разрыву капсулы [13]. Иктеричность может присутствовать. Возможны нарушения зрения. При подозрении на любое из вышеперечисленных осложнений следует провести соответствующий медицинский осмотр.[14]
Иктеричность может присутствовать. Возможны нарушения зрения. При подозрении на любое из вышеперечисленных осложнений следует провести соответствующий медицинский осмотр.[14]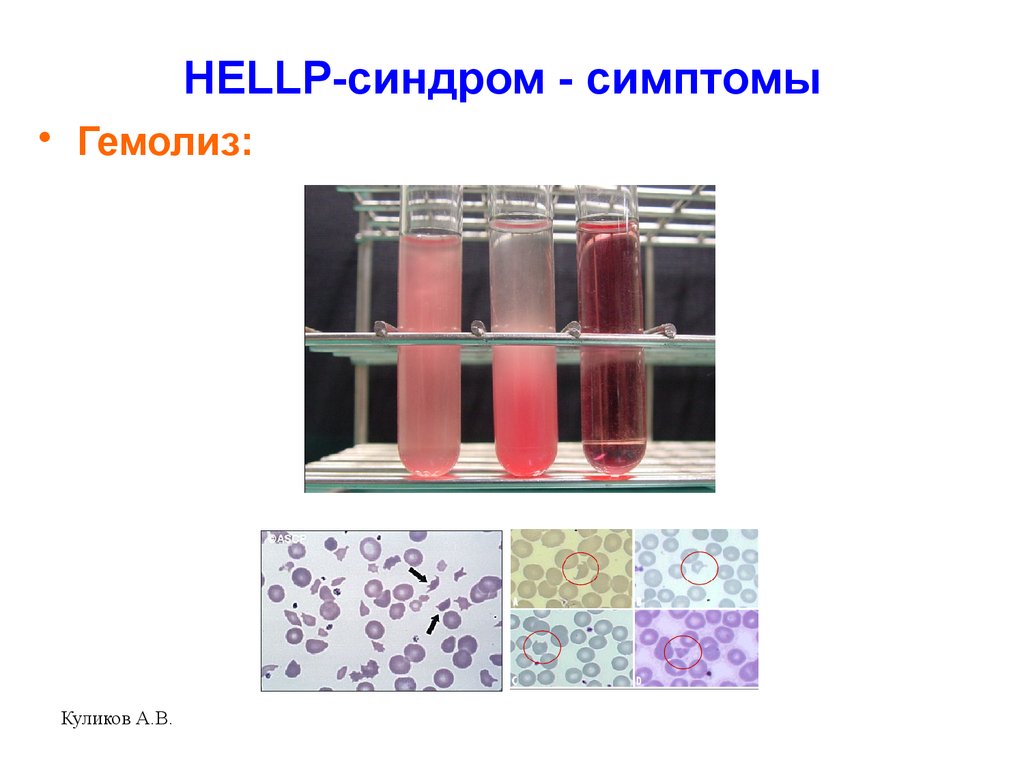 [5]
[5]


 В двух крупных двойных слепых рандомизированных исследованиях не было доказано преимущества назначения дексаметазона у пациентов с HELLP-синдромом, поскольку он не улучшал материнские или перинатальные/младенческие исходы.[18][19]]
В двух крупных двойных слепых рандомизированных исследованиях не было доказано преимущества назначения дексаметазона у пациентов с HELLP-синдромом, поскольку он не улучшал материнские или перинатальные/младенческие исходы.[18][19]] У этих больных повышен уровень аммиака. Присутствует гипогликемия, в отличие от синдрома HELLP.
У этих больных повышен уровень аммиака. Присутствует гипогликемия, в отличие от синдрома HELLP. Функциональные пробы печени в норме, желтуха при волчанке отсутствует. Гипертензия и протеинурия могут присутствовать подобно HELLP-синдрому. У них есть другие типичные характеристики волчаночноподобной скуловой сыпи, плеврита, артрита и перикардиального выпота.
Функциональные пробы печени в норме, желтуха при волчанке отсутствует. Гипертензия и протеинурия могут присутствовать подобно HELLP-синдрому. У них есть другие типичные характеристики волчаночноподобной скуловой сыпи, плеврита, артрита и перикардиального выпота. Смертность женщин с HELLP-синдромом составляет 0-24%, перинатальная смертность достигает 37%.[11] Материнская смерть происходит из-за диссеминированного внутрисосудистого свертывания крови (ДВС-синдром), отслойки плаценты, послеродового кровотечения или острой почечной недостаточности. ДВС-синдром встречается в 15–62,5 % случаев. Отслойка плаценты происходит у 11–25 % женщин с синдромом HELLP. Послеродовое кровотечение возникает в 12,5-40% случаев, а острая почечная недостаточность — в 36-50% случаев. Плохой перинатальный прогноз обусловлен отслойкой плаценты, внутриутробной гипоксией, асфиксией, недоношенностью и низкой массой тела при рождении [22].
Смертность женщин с HELLP-синдромом составляет 0-24%, перинатальная смертность достигает 37%.[11] Материнская смерть происходит из-за диссеминированного внутрисосудистого свертывания крови (ДВС-синдром), отслойки плаценты, послеродового кровотечения или острой почечной недостаточности. ДВС-синдром встречается в 15–62,5 % случаев. Отслойка плаценты происходит у 11–25 % женщин с синдромом HELLP. Послеродовое кровотечение возникает в 12,5-40% случаев, а острая почечная недостаточность — в 36-50% случаев. Плохой перинатальный прогноз обусловлен отслойкой плаценты, внутриутробной гипоксией, асфиксией, недоношенностью и низкой массой тела при рождении [22]. Материнские осложнения включают:
Материнские осложнения включают: Риск материнских и перинатальных осложнений и смертности должен быть разъяснен пациентке и ее семье. Риск развития HELLP при последующих беременностях можно снизить, если вести здоровый образ жизни и предотвращать такие заболевания, как гипертония и диабет. Следует соблюдать регулярные физические упражнения. Рутинный дородовой уход и лабораторные анализы должны быть начаты на ранних сроках последующих беременностей.
Риск материнских и перинатальных осложнений и смертности должен быть разъяснен пациентке и ее семье. Риск развития HELLP при последующих беременностях можно снизить, если вести здоровый образ жизни и предотвращать такие заболевания, как гипертония и диабет. Следует соблюдать регулярные физические упражнения. Рутинный дородовой уход и лабораторные анализы должны быть начаты на ранних сроках последующих беременностей. Нефролог может быть привлечен, если у пациента развивается острая почечная недостаточность. Привлечение гепатолога и хирургической бригады необходимо, если у пациента развиваются такие осложнения, как гематома или разрыв печени. Вмешательство офтальмолога может быть необходимо, если у пациента развиваются какие-либо изменения зрения. Неонатолог может быть привлечен на раннем этапе, чтобы избежать неонатальных осложнений.
Нефролог может быть привлечен, если у пациента развивается острая почечная недостаточность. Привлечение гепатолога и хирургической бригады необходимо, если у пациента развиваются такие осложнения, как гематома или разрыв печени. Вмешательство офтальмолога может быть необходимо, если у пациента развиваются какие-либо изменения зрения. Неонатолог может быть привлечен на раннем этапе, чтобы избежать неонатальных осложнений. Этот межпрофессиональный командный подход поможет добиться положительных результатов лечения пациентов с HELLP-синдромом. [Уровень 5]
Этот межпрофессиональный командный подход поможет добиться положительных результатов лечения пациентов с HELLP-синдромом. [Уровень 5] Акушерство Гинекол. 2014 март; 123(3):618-627. [PubMed: 24499757]
Акушерство Гинекол. 2014 март; 123(3):618-627. [PubMed: 24499757] Eur J Obstet Gynecol Reprod Biol. 2013 февраль; 166(2):117-23. [PubMed: 23107053]
Eur J Obstet Gynecol Reprod Biol. 2013 февраль; 166(2):117-23. [PubMed: 23107053] Фронт Иммунол. 2020;11:667. [Бесплатная статья PMC: PMC7174768] [PubMed: 32351511]
Фронт Иммунол. 2020;11:667. [Бесплатная статья PMC: PMC7174768] [PubMed: 32351511] Инфаркт печени, гематома и разрыв при синдроме HELLP: поддержка вазоспастической гипотезы. J Matern Fetal Neonatal Med. 2021 15 июня;: 1-6. [В паблике: 34130599]
Инфаркт печени, гематома и разрыв при синдроме HELLP: поддержка вазоспастической гипотезы. J Matern Fetal Neonatal Med. 2021 15 июня;: 1-6. [В паблике: 34130599] Послеродовой дексаметазон для женщин с гемолизом, повышенными ферментами печени и синдромом низкого уровня тромбоцитов (HELLP): двойное слепое, плацебо-контролируемое, рандомизированное клиническое исследование. Am J Obstet Gynecol. 2008 март; 198(3):283.e1-8. [PubMed: 18194800]
Послеродовой дексаметазон для женщин с гемолизом, повышенными ферментами печени и синдромом низкого уровня тромбоцитов (HELLP): двойное слепое, плацебо-контролируемое, рандомизированное клиническое исследование. Am J Obstet Gynecol. 2008 март; 198(3):283.e1-8. [PubMed: 18194800]