Содержание
Тиреотропный гормон (ТТГ): исследования в лаборатории KDLmed
Тиреотропный гормон (ТТГ) – основной регулятор функции щитовидной железы, синтезирующийся гипофизом – небольшой железой, которая расположена на нижней поверхности головного мозга. Основная его функция – поддерживать постоянную концентрацию тиреоидных гормонов, которые регулируют процессы образования энергии в организме. Когда их содержание в крови понижается, гипоталамус высвобождает гормон, стимулирующий секрецию ТТГ гипофизом.
Синонимы русские
Тиреостимулирующий гормон, тиреотропин, ТТУ.
Синонимы английские
Thyroid-stimulating Hormone (THS), Thyrotropin.
Метод исследования
Иммунохемилюминесцентный анализ.
Единицы измерения
МкМЕ/мл (микромеждународная единица на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 2-3 часов перед исследованием (можно пить чистую негазированную воду).
- Исключить приём стероидных и тиреоидных гормонов за 48 часов до сдачи анализа (по согласованию с врачом).
- Исключить физическое и эмоциональное перенапряжение за 24 часа до исследования.
- Не курить в течение 3 часов до исследования.
Общая информация об исследовании
Тиреотропный гормон (ТТГ) вырабатывается гипофизом, небольшой железой, расположенной на нижней поверхности головного мозга позади синусной впадины. Он регулирует выработку гормонов щитовидной железы (тироксина и трийодтиронина) по «системе обратной связи», которая позволяет поддерживать стабильную концентрацию этих гормонов в крови. При снижении концентрации тиреоидных гормонов повышается секреция тиреотропного гормона и стимулируется их выработка щитовидной железой, и наоборот – при повышении концентрации тироксина и трийодтиронина секреция тиреотропного гормона падает. Гормоны щитовидной железы являются основными регуляторами расхода энергии в организме, и поддержание их концентрации на необходимом уровне крайне важно для нормальной деятельности практически всех органов и систем.
Гормоны щитовидной железы являются основными регуляторами расхода энергии в организме, и поддержание их концентрации на необходимом уровне крайне важно для нормальной деятельности практически всех органов и систем.
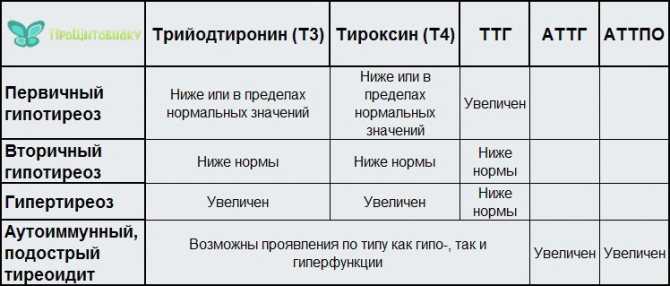
Дисфункция гипофиза может вызывать повышение или понижение уровня тиреотропного гормона. При повышении его концентрации тиреоидные гормоны выделяются в кровь в аномальных количествах, вызывая гипертиреоз. При снижении концентрации тиреотропного гормона выработка тиреоидных гормонов также снижается и развиваются симптомы гипотиреоза.
Причинами нарушения выработки тиреотропного гормона могут быть заболевания гипоталамуса, который начинает продуцировать повышенные или пониженные количества тиреолиберина – регулятора секреции ТТГ гипофизом. Заболевания щитовидной железы, сопровождающиеся нарушением секреции тиреоидных гормонов, могут опосредованно (по механизму обратной связи) влиять на секрецию тиреотропного гормона, вызывая понижение или повышение его концентрации в крови.
Для чего используется исследование?
- Для оценки состояния щитовидной железы.
- Для контроля за терапией заболеваний щитовидной железы.
- Для диагностики нарушения функции щитовидной железы у новорождённых.
- Для диагностики женского бесплодия и контроля за его лечением.
Когда назначается исследование?
- При увеличении щитовидной железы, а также при симптомах гипер- и гипотиреоза.
- Симптомы гипертиреоза:
- учащённое сердцебиение,
- повышенная тревожность,
- снижение массы тела,
- бессонница,
- дрожание рук,
- слабость, быстрая утомляемость,
- диарея,
- непереносимость яркого света,
- снижение остроты зрения,
- отечность вокруг глаз, их сухость, гиперемия, выпучивание.
- Симптомы гипотиреоза:
- сухость кожи,
- запоры,
- непереносимость холода,
- отеки,
- выпадение волос,
- слабость, повышенная утомляемость,
- нарушение менструального цикла у женщин.

- Симптомы гипертиреоза:
- Через регулярные интервалы времени анализ может назначаться для контроля за эффективностью терапии заболеваний щитовидной железы. Уровень ТТГ часто оценивается у новорождённых, входящих в группу риска по заболеваниям щитовидной железы.
Что означают результаты?
Референсные значения
| Возраст | Референсные значения |
| 0,7 — 11 мкМЕ/мл | |
| 4 месяца — 1 год | 0,7 — 8,35 мкМЕ/мл |
| 1 — 7 лет | 0,7 — 6 мкМЕ/мл |
| 7 — 12 лет | 0,6 — 4,8 мкМЕ/мл |
| 12 — 20 лет | 0,5 — 4,3 мкМЕ/мл |
| > 20 лет | 0,3 — 4,2 мкМЕ/мл |
Причины повышения концентрации тиреотропного гормона:
- гипотиреоз (первичный и вторичный),
- опухоль гипофиза (тиреотропинома, базофильная аденома),
- тиреоидит Хашимото,
- синдром нерегулируемой секреции ТТГ,
- тиротропин-секретирующие опухоли легкого,
- надпочечниковая недостаточность,
- преэклампсия,
- отравления свинцом,
- психические заболевания.

Причины понижения концентрации тиреотропного гормона:
- диффузный токсический зоб,
- ТТГ-независимый тиреотоксикоз,
- тиреотоксическая аденома (болезнь Пламмера),
- гипертиреоз беременных,
- аутоиммунный тиреоидит с проявлениями тиреотоксикоза,
- психические заболевания,
- кахексия.
Повышение и понижение уровня тиреотропного гормона указывает на нарушения в регуляции функции щитовидной железы, однако выяснить точную их причину по одному лишь уровню ТТГ часто невозможно. Обычно для этого дополнительно определяют уровень тироксина (Т4) и трийодтиронина (Т3).
Важные замечания
- Следующие лекарственные препараты могут приводить к завышению концентрации тиреотропного гормона: фенитоин, атенолол, кломифен, мотилиум, метопролол, вальпроевая кислота, пропранолол, амиодарон, кальцитонин, преднизолон, морфин, производные фенотиазина, бензеразид, аминоглютетимид, метоклопрамид, фуросемид, иодиды, ловастатин, метимазол, дифенин, рифампицин.

- Уровень тиреотропного гормона отражает ситуацию в системе гипофиз – щитовидная железа за последние 3-6 недель, поэтому контрольное определение концентрации ТТГ в крови желательно проводить через 2 месяца после корректировки дозы препаратов, влияющих на уровень гормона.
- На уровень тиреотропного гормона может влиять физическая и эмоциональная нагрузка, острые инфекционные заболевания.
- В некоторых исследованиях было показано изменение уровня ТТГ в течение дня. Поэтому в целях мониторинга концентрации ТТГ рекомендуется сдавать анализ в одно и то же время суток.
- У беременных в III триместре уровень ТТГ может быть повышенным.
Также рекомендуется
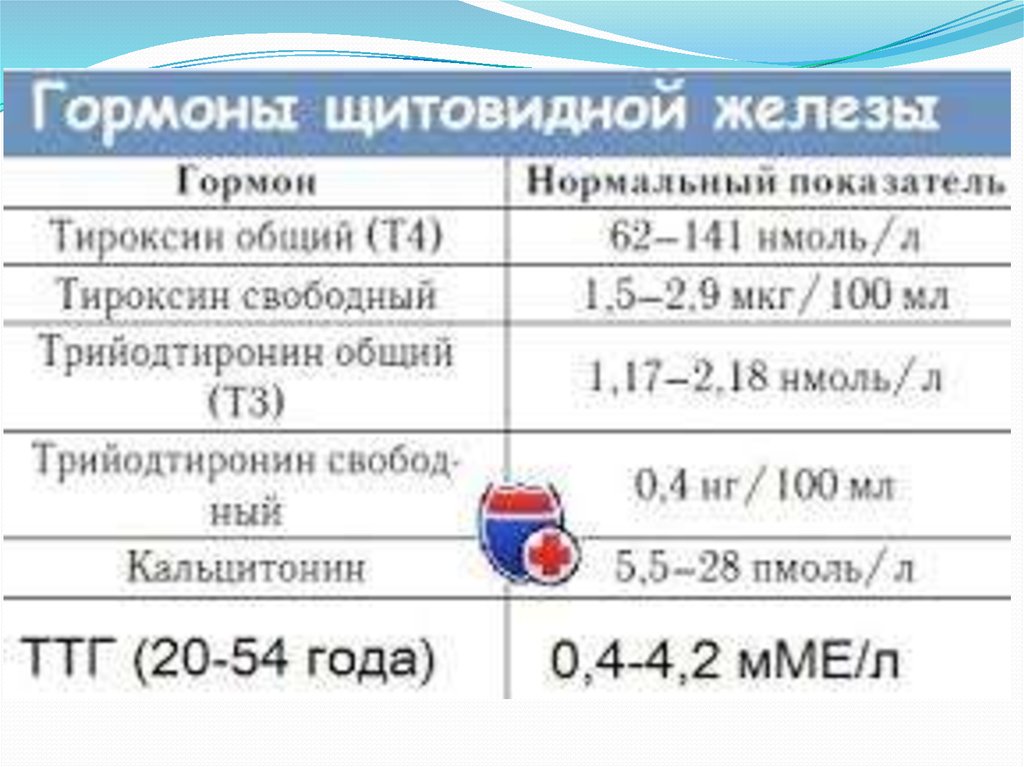
- Трийодтиронин общий (Т3 общий
- Тироксин общий (Т4 общий)
- Тироксин свободный (Т4 свободный)
- Трийодтиронин свободный (Т3 свободный)
- Антитела к тиреопероксидазе (антиТПО)
- Антитела к тиреоглобулину (антиТГ)
Кто назначает исследование?
Эндокринолог, терапевт, педиатр, гинеколог, невролог, хирург.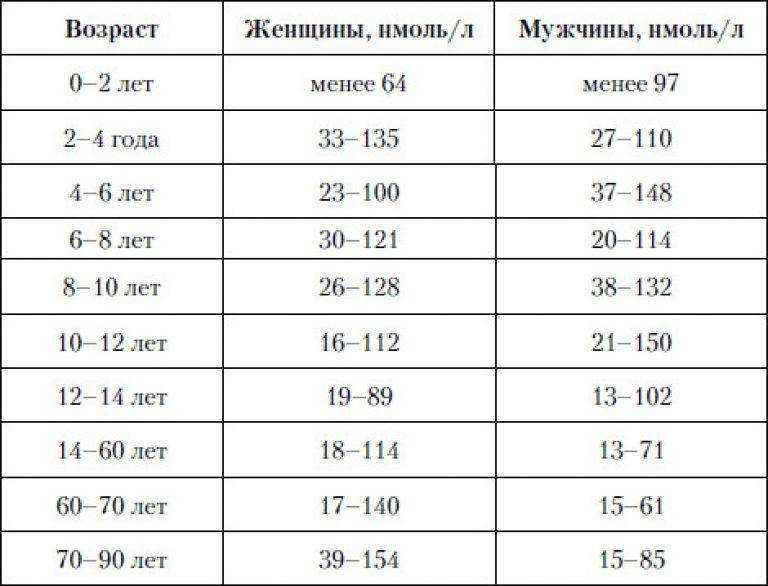
Диффузный токсический зоб | Городская клиническая больница им. Ф.И. Иноземцева
Диффузный токсический зоб (ДТЗ, гипертиреоз, болезнь
Грейвса-Базедова) – аутоиммунное заболевание, развивающееся вследствие
выработки антител к репепторам ТТГ (рТТГ), клинически проявляющееся поражением щитовидной
железы (ЩЖ) с развитием синдрома тиреотоксикоза. Стоит отметить, что
вырабатывающиеся при ДТЗ антитела оказывают на орган-мишень не разрушающее, как
при других аутоиммунных заболеваниях, а стимулирующее действие.
Впервые это заболевание
было описано в 1835 году ирландцем Робертом Джеймсом Грейвсом (1797–1853).
Почти одновременно с ним, в 1840 году, немецкий врач Карл Адольф фон
Базедов (1799–1854) описал наблюдаемую им у четырех пациентов так
называемую мерзебургскую триаду (по названию города Мерзебурга, где он
работал) — тахикардию, экзофтальм и зоб, которые являются
характерными симптомами ДТЗ. Сам Базедов назвал описанное им заболевание
экзофтальмической кахексией.
КЛИНИЧЕСКАЯ КАРТИНА:
Жалобы: на увеличение ЩЖ, повышенную возбудимость, эмоциональную
лабильность, плаксивость, беспокойство, нарушение сна, суетливость, нарушение
концентрации внимания, слабость, частый стул, нарушение менструального цикла,
снижение потенции
Сердечно-сосудистая система: экстрасистолия,
постоянная или реже пароксизмальная синусовая тахикардия, фибрилляция
предсердий (мерцательная аритмия) с повышенным риском тромбоэмболических
осложнений, артериальная гипертензия => миокардиодистрофия и сердечная
недостаточность.
Катаболический
синдром: похудание при повышенном аппетите, горячие кожные
покровы, субфебрилитет, избыточная потливость, мышечная слабость
Синдром
эктодермальных нарушений: ломкость ногтей, ломкость и
выпадение волос
Нервная система: тремор рук (симптом
Мари) и/или всего тела (симптом телеграфного столба), повышение сухожильных
рефлексов
Глаза: у части пациентов развивается эндокринная офтальмопатия; характеризующаяся поражением мягких тканей орбиты, зрительного нерва и вспомогательного аппарата глаз (слезной железы, роговицы, конъюнктивы и век)
ДИАГНОСТИКА:
ЛАБОРАТОРНЫЕ ПОКАЗАТЕЛИ (высокий уровень свободного Т4 и свободного Т3 и низкое содержание ТТГ в крови). Специфическим маркером ДТЗ являются антитела к рТТГ.
ДТЗ = ↓ТТГ + ↑ Т4 свободный + ↑Т3 свободный + ↑антитела к рецепторам ТТГ
УЗИ (проводится всем пациентам с тиреотоксикозом) определяется объем и эхоструктура ЩЖ. В норме объем ЩЖ у женщин не должен превышать 18 см3, у мужчин 25 см3. Эхогенность железы средняя, структура равномерная. Эхогенность железы при тиреотоксикозе равномерно снижена, структура неодноднородная, кровоснабжение усилено.
В норме объем ЩЖ у женщин не должен превышать 18 см3, у мужчин 25 см3. Эхогенность железы средняя, структура равномерная. Эхогенность железы при тиреотоксикозе равномерно снижена, структура неодноднородная, кровоснабжение усилено.
СЦИНТИГРАФИЯ используется для определения функциональной активности ЩЖ и дифференциальной
диагностики диффузного и узлового токсического зобов. Наиболее часто для
сканирования ЩЖ используется изотоп технеция – 99mTc (имеет короткий период
полураспада – 6 часов, что значительно уменьшает дозу облучения), I123,
реже I131. При ДТЗ отмечается равномерное распределение изотопа. При
функциональной автономии изотоп накапливает активно функционирующий узел, при
этом окружающая тиреоидная ткань находится в состоянии супрессии. По накоплению
и распределению изотопа можно судить о функциональной активности ЩЖ, о
характере ее поражения (диффузном или узловом), об объеме ткани после резекции
или тиреоидэктомии, о наличии эктопированной ткани.
МСКТ и МРТ помогают определить
размеры и расположение ЩЖ, расположение по отношению к окружающим структурам, выявить
смещение или сдавление трахеи и пищевода.
ЛЕЧЕНИЕ:
Консервативное (прием антитиреоидных препаратов)
Консервативное лечение назначается для достижения эутиреоза перед оперативным лечением или радиойоДтерапией, а также, в отдельных группах пациентов, в качестве базового длительного курса лечения, который, в некоторых случаях, приводит к стойкой ремиссии. В первую очередь, речь идет о пациентах с умеренным увеличением объема ЩЖ (до 40 мл). Тиамазол (тирозол, мерказолил) является препаратом выбора для всех пациентов, которым планируется проведение консервативного лечения ДТЗ, за исключением лечения ДТЗ в первом триместре беременности, тиреотоксического криза и развития побочных эффектов на тиамазол, когда предпочтение следует отдать пропилтиоурацилу (ПТУ, пропицилу). При наличии стойких умеренных и легких побочных эффектов антитиреоидной терапии необходимо отменить тиреостатик и направить пациента на терапию радиоактивным йодом или хирургическое вмешательство, или перевести его на другое антитиреоидное средство, если терапия радиоактивным йодом или операция пока не показаны.
Если тиамазол
выбран в качестве начальной терапии ДТЗ, то лекарственная терапия должна
продолжаться около 12-18 месяцев, после чего она постепенно отменяется, если у
пациента нормальный уровень ТТГ. Перед отменой тиреостатической терапии
желательно определить уровень антител к рТТГ, так как это помогает в
прогнозировании исхода лечения: больше шансов на стойкую ремиссию имеют
пациенты с низким уровнем антител к рТТГ. При правильно проведенном лечении
частота рецидивов после отмены тиреостатических препаратов составляет 70% и
более. Если у пациента с ДТЗ после отмены тиамазола вновь развивается
тиреотоксикоз, необходимо рассмотреть вопрос о проведении радиойодтерапии или
тиреоидэктомии.
Длительную
консервативную терапию нецелесообразно планировать у пациентов с выраженными
осложнениями тиреотоксикоза (фибрилляция предсердий, остеопороз и др.)
Оперативное
При ДТЗ объем оперативного лечения один – тотальная тиреоидэктомия.
Перед проведением
тиреоидэктомии необходимо достижение эутиреоидного состояния (нормальный
уровень свободного Т3, свободного Т4) на фоне терапии тиреостатиками.
В
послеоперационном периоде в обязательном порядке производится определение
уровня кальция, осмотр ЛОР врачом (на предмет подвижности голосовых складок).
Препараты левотироксина (эутирокс, L-тироксин) назначаются из расчета 1.7
мкг/кг веса пациента. Определить уровень ТТГ следует через 6-8 недель после
операции.
Лечение радиоактивным йодом (РЙТ)
РЙТ при ДТЗ
проводится в случае рецидива тиреотоксикоза после правильно проведенного консервативного
лечения (непрерывная терапия тиреостатическими препаратами с подтвержденным
эутиреозом в течение 12-18 месяцев), невозможности приема тиреостатических
препаратов (лейкопения, аллергические реакции), отсутствия условий для
консервативного лечения и наблюдения за больным.
Целью
радиойодтерапии является ликвидация тиреотоксикоза путем разрушения
гиперфункционирующей ткани ЩЖ и достижение стойкого гипотиреоидного состояния.
Минусы:
- Дороговизна
метода и длительность ожидания очереди; - Объем
ЩЖ не должен превышать 40 см3; - Противопоказана
при беременности, лактации и эндокринной офтальмопатии; - Лучевую нагрузку получают все ткани и органы;
Рецидив тиреотоксикоза.
Целиакия | Выберите правильный тест
Показания для тестирования
Дети и подростки
Хронические, необъяснимые гастроэнтерологические симптомы, плохой рост, потеря веса, задержка полового созревания, железодефицитная анемия и аномальные результаты анализов печени у детей или подростков требуют тестирования на целиакию. Дети и подростки с определенным фактором риска БК также должны быть обследованы, даже если они не имеют симптомов. Факторы риска включают аутоиммунные заболевания (например, сахарный диабет 1 типа, аутоиммунный тиреоидит или аутоиммунное заболевание печени), синдромы, связанные с БК (например, синдромы Дауна, Тернера или Вильямса), селективный дефицит IgA и родственников первой степени родства с БК.
Взрослые
Хронические, необъяснимые желудочно-кишечные симптомы, необъяснимый дефицит железа, герпетиформный дерматит, рецидивирующий афтозный стоматит, остеопороз с ранним началом, задержка полового созревания/необъяснимая низкорослость или очаговая алопеция. Взрослые с фактором риска CD также должны пройти тестирование, даже если они не имеют симптомов. Факторы риска у взрослых включают семейный анамнез БК, синдромы, связанные с БК (например, синдром Дауна, синдром Тернера), аутоиммунные заболевания, связанные с БК (например, сахарный диабет 1 типа, заболевания щитовидной железы, воспалительные заболевания кишечника [ВЗК]) или селективные Дефицит IgA.
Критерии диагностики
Американская гастроэнтерологическая ассоциация (AGA) и Европейское общество детской гастроэнтерологии, гепатологии и питания (ESPGHAN) предложили следующие критерии для диагностики БК: 9t 9t 03 Положительный
9 Результаты IgA или результаты теста на основе IgG в случаях известного дефицита IgA, плюс биопсия, соответствующая БК,
или
Пациент должен соблюдать глютенсодержащую диету при выполнении любого серологического теста или биопсии. Для биопсии двенадцатиперстной кишки, золотого стандарта диагностики, предпочтительно пять или более образцов для повышения вероятности точного результата: один или более образцов из луковицы и четыре или более образцов из второй и третьей части двенадцатиперстной кишки рекомендуется. Поражение кишечника оценивается с использованием модифицированной классификации Марша гистологических данных на CD или упрощенная системная классификация.
Для биопсии двенадцатиперстной кишки, золотого стандарта диагностики, предпочтительно пять или более образцов для повышения вероятности точного результата: один или более образцов из луковицы и четыре или более образцов из второй и третьей части двенадцатиперстной кишки рекомендуется. Поражение кишечника оценивается с использованием модифицированной классификации Марша гистологических данных на CD или упрощенная системная классификация.
Американский колледж гастроэнтерологии и Всемирная гастроэнтерологическая ассоциация выпустили аналогичные рекомендации по диагностике целиакии.
Лабораторные исследования
Диагностика
Тестирование дефицита IgA
Определение уровня IgA в сыворотке с помощью нефелометрии является рекомендуемым тестом для оценки общего уровня IgA, и его следует назначать одновременно с тестом tTG IgA. Если у пациента дефицит IgA (т. е. уровень IgA не определяется ), серологическое тестирование второго этапа следует проводить с использованием тестов IgG, чтобы предотвратить ложноотрицательные результаты антител. Рекомендуемые тесты на IgG включают тесты на тТГ, ЭМА и дезамидированный пептид глиадина (ДГП).
Если у пациента дефицит IgA (т. е. уровень IgA не определяется ), серологическое тестирование второго этапа следует проводить с использованием тестов IgG, чтобы предотвратить ложноотрицательные результаты антител. Рекомендуемые тесты на IgG включают тесты на тТГ, ЭМА и дезамидированный пептид глиадина (ДГП).
У младенцев могут наблюдаться временные субоптимальные уровни IgA и/или IgG, которые могут не быть связаны с иммунодефицитом.
Дефицит IgA может сопровождаться дефицитом других иммуноглобулинов. Рассмотрите возможность оценки пациента на иммунодефицит, если уровни IgA ниже предела обнаружения.
Подробную информацию об интерпретации следующих специфических тестов на антитела см. в таблице «Интерпретация результатов теста на антитела» ниже.
Антитела к тканевой трансглутаминазе
Тест tTG IgA рекомендуется для первоначального скрининга целиакии у IgA-компетентных лиц. Чем выше титр, тем выше вероятность истинно положительного результата. Хотя объединение нескольких тестов может немного повысить чувствительность, оно также снижает специфичность, поэтому для людей с низким риском развития целиакии рекомендуется консервативный подход к тестированию. Кроме того, серологическое тестирование БК может быть вариабельным на ранних стадиях заболевания или при низком уровне антител. Чтобы исключить ложную серопозитивность у пациентов с низкими титрами антител, но нормальной слизистой оболочкой тонкой кишки, рассмотрите возможность повторных серологических тестов через 6 месяцев (пациент должен продолжать употреблять глютен). Пациентам с дефицитом IgA рекомендуется тестирование tTG IgG (в сочетании с тестированием EMA или DGP IgG). Не рекомендуется отказываться от гистологического исследования у лиц с дефицитом IgA.
Чем выше титр, тем выше вероятность истинно положительного результата. Хотя объединение нескольких тестов может немного повысить чувствительность, оно также снижает специфичность, поэтому для людей с низким риском развития целиакии рекомендуется консервативный подход к тестированию. Кроме того, серологическое тестирование БК может быть вариабельным на ранних стадиях заболевания или при низком уровне антител. Чтобы исключить ложную серопозитивность у пациентов с низкими титрами антител, но нормальной слизистой оболочкой тонкой кишки, рассмотрите возможность повторных серологических тестов через 6 месяцев (пациент должен продолжать употреблять глютен). Пациентам с дефицитом IgA рекомендуется тестирование tTG IgG (в сочетании с тестированием EMA или DGP IgG). Не рекомендуется отказываться от гистологического исследования у лиц с дефицитом IgA.
Антитела к эндомизиальному и дезамидированному глиадиновому пептиду
Хотя EMA-тестирование является дорогостоящим и зависит от опыта наблюдателя, оно высокоспецифично для БК и может помочь снизить вероятность ложноположительных результатов tTG. Тест DGP IgA, а не тест EMA, может быть полезен у детей младше 2 лет , но не рекомендуется как часть начального скрининга.
Тест DGP IgA, а не тест EMA, может быть полезен у детей младше 2 лет , но не рекомендуется как часть начального скрининга.
Интерпретация результатов теста на антитела
| Тест | Результат | Интерпретация и/или следующий шаг |
|---|---|---|
| тТГ IgA | Высокоположительный (≥41 ЕД/мл) | КД; заказать EMA IgA по IFA (предпочтительно) и/или DGP IgA |
| Слабая-умеренная (4-40 Ед/мл) | Заказать EMA IgA через IFA и/или DGP IgA | |
| Отрицательный результат (≤3 ЕД/мл) | CD вряд ли; проверить общий IgA на дефицит; исключить в анамнезе безглютеновую диету или иммунодепрессанты, которые могут привести к ложноотрицательным результатам | |
| EMA и/или DGP IgA | Отрицательный результат при наличии высоких уровней tTG IgA | Рассмотрите биопсию и HLA генотипирование a |
| Положительный при наличии высоких уровней tTG IgA | CD подтвержден | |
| Скрининг на два антигена CD с рефлексом | Обычный | компакт-диск вряд ли |
| Положительный | КД; рефлекторное тестирование включает ТТГ и ДГП (IgA и IgG) по отдельности; заказать EMA IgA по IFA (предпочтительно) | |
| тТГ IgG | Обычный | компакт-диск вряд ли |
| Положительный | КД скорее всего; заказать EMA IgG с помощью IFA (предпочтительно) и/или DGP IgG | |
a См. ИФА, непрямое флуоресцентное антитело | ||
HLA Генотипирование
Ассоциации HLA-DQ2 и HLA-DQ8 с целиакией являются одними из самых сильных ассоциаций HLA с болезнью, известных в настоящее время. HLA-DQ2 присутствует примерно у 90% пациентов с болезнью Крона; остальные 5-10% несут HLA-DQ8 .
Поскольку эти генотипы распространены среди населения в целом, положительный результат позволяет, но не устанавливает диагноз целиакии. Однако его можно использовать для подтверждения клинического диагноза (например, в случаях подозрения на серонегативную БК ), оценки риска БК и информирования о необходимости дальнейшего тестирования. Отрицательный результат можно надежно использовать для исключения целиакии.
Тестирование HLA на целиакию может быть информативным, когда первоначальные результаты теста пациента противоречивы, двусмысленны или сомнительны по иным причинам. Это тестирование также может быть полезно для определенных групп пациентов, в том числе для тех, кто отказывается от биопсии, придерживается безглютеновой диеты (что влияет на серологическое исследование) или подвергается повышенному риску БК, например, у лиц с родственниками первой степени родства, у которых подтвержденный компакт-диск. К другим группам риска относятся лица с состояниями, обычно связанными с БК (например, аутоиммунные заболевания, диабет 1 типа, заболевания печени или щитовидной железы) или с заболеваниями, связанными с хромосомными аномалиями, такими как синдромы Вильямса, Тернера и Дауна.
Это тестирование также может быть полезно для определенных групп пациентов, в том числе для тех, кто отказывается от биопсии, придерживается безглютеновой диеты (что влияет на серологическое исследование) или подвергается повышенному риску БК, например, у лиц с родственниками первой степени родства, у которых подтвержденный компакт-диск. К другим группам риска относятся лица с состояниями, обычно связанными с БК (например, аутоиммунные заболевания, диабет 1 типа, заболевания печени или щитовидной железы) или с заболеваниями, связанными с хромосомными аномалиями, такими как синдромы Вильямса, Тернера и Дауна.
Когда клинически показано тестирование HLA , общий генетический риск CD у пациентов с CD-ассоциированными генотипами может быть стратифицирован по дозе гена и комбинации аллеля. Дополнительную информацию о том, как результаты теста HLA информируют о риске CD, см. в информационном бюллетене о тесте на генотипирование на целиакию HLA-DQ .
Прогноз
Антиактин (F-актин) IgA
Анализ антиактина (F-актин) IgA с помощью твердофазного иммуноферментного анализа (ИФА) может предоставить информацию о прогнозе и должен выполняться в случаях БК, подтвержденных биопсией. Уровни коррелируют с тяжестью повреждения слизистой оболочки: наличие антиактиновых антител может указывать на атрофию кишечных ворсинок и более тяжелую форму заболевания. Хотя результат теста на F-актин может указывать на заболевание средней и тяжелой степени, тесту не хватает специфичности.
Уровни коррелируют с тяжестью повреждения слизистой оболочки: наличие антиактиновых антител может указывать на атрофию кишечных ворсинок и более тяжелую форму заболевания. Хотя результат теста на F-актин может указывать на заболевание средней и тяжелой степени, тесту не хватает специфичности.
Скрининг
Недостаточно доказательств для рекомендации скрининга у бессимптомных лиц при отсутствии факторов риска БК. Серологический скрининг на БК рекомендуется для определенных групп риска, включая ближайших родственников пациентов с БК и лиц, у которых есть следующие :
- Аутоиммунные заболевания (сахарный диабет 1 типа, аутоиммунное заболевание щитовидной железы или аутоиммунный гепатит)
- Генетические синдромы, ассоциированные с БК (синдромы Дауна, Тернера и Вильямса)
- Селективный дефицит IgA
Для бессимптомных детей с вышеуказанными факторами риска скрининг начинайте, когда ребенок употребляет глютен в течение как минимум 1 года.
Мониторинг
Мониторинг следует проводить для оценки терапевтического ответа на изменение диеты и соблюдения диеты пациентом. Тестирование, используемое для мониторинга БК, включает те же методы, которые рекомендованы для диагностики (например, гистологическое и серологическое тестирование). В зависимости от предыдущих результатов анализы tTG, DGP или EMA могут использоваться для мониторинга соблюдения безглютеновой диеты. В случаях известного дефицита IgA следует использовать тестирование на IgG.
Серологическое исследование глютеновой болезни, особенно tTG IgA и DGP IgA, рекомендуется проводить каждые 3–6 месяцев после первоначального диагноза до нормализации аномальных исходных результатов или до клинической стабилизации состояния пациента, а затем каждые 1–2 года. Если уровни антител остаются повышенными после более чем 12 месяцев безглютеновой диеты, рассмотрите возможность повторной биопсии. Снижение уровня антител, включая F-актин IgA, может коррелировать с нормализацией кишечных ворсинок.
Иммуноглобулин G (IgG) Антитела к тканевой трансглютаминазе, используемые в качестве маркеров для пациентов с глютеновой болезнью с дефицитом IgA
1. Мужено. 2004. Диагностика глютеновой болезни: сравнение антител трансглютаминазы тканей человека с антиглиадиновыми и антиэндомизиальными антителами. Арка Педиатр. Подросток Мед. 158 : 584-588. [PubMed] [Google Scholar]
2. Burgin-Wolff, A., I. Dahlbom, F. Hadziselimovic, and C.J. Petersson. 2002. Антитела против трансглютаминазы тканей человека и эндомизия в диагностике и мониторинге глютеновой болезни. Сканд. Дж. Гастроэнтерол. 37 : 685-691. [PubMed] [Google Scholar]
3. Карроччо, А., Г. Витале, Л. Ди Прима, Н. Чифари, С. Наполи, К. Ла Русса, Г. Гулотта, М. Р. Аверна, Г. Монтальто, С. Мансуэто и А. Нотарбартоло. 2002. Сравнение анти-трансглютаминазного ИФА и анализа антиэндомизиальных антител в диагностике глютеновой болезни: проспективное исследование. клин. хим. 48 : 1546-1550. [PubMed] [Google Scholar]
клин. хим. 48 : 1546-1550. [PubMed] [Google Scholar]
4. Cataldo, F., D. Lio, V. Marino, A. Picarelli, A. Ventura, G. R. Corazza, et al. 2000. IgG 1 антитела к эндомизию и IgG к тканевой трансглутаминазе (анти-тТГ) у пациентов с глютеновой болезнью с селективным дефицитом IgA. Гут 47 : 366-369. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Cataldo, F., V. Marino, G. Bottaro, P. Greco, and A. Ventura. 1997. Целиакия и дефицит селективного иммуноглобулина А. Дж. Педиатр. 131 : 306-308. [PubMed] [Google Scholar]
6. Cataldo, F., V. Marino, A. Ventura, G. Bottaro, G. R. Corazza, et al. 1998. Распространенность и клинические признаки дефицита селективного иммуноглобулина А при глютеновой болезни: итальянское многоцентровое исследование. Гут 42 : 362-365. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Catassi, C. , G. Fanciulli, A.R. D’Appello, R. El Asmar, C. Rondina, E. Fabiani, I. Bearzi и G.V. Коппа. 2000. Antiendomysium против антиглиадиновых антител при скрининге населения в целом на целиакию. Сканд. Дж. Гастроэнтерол. 35 : 732-736. [PubMed] [Google Scholar]
, G. Fanciulli, A.R. D’Appello, R. El Asmar, C. Rondina, E. Fabiani, I. Bearzi и G.V. Коппа. 2000. Antiendomysium против антиглиадиновых антител при скрининге населения в целом на целиакию. Сканд. Дж. Гастроэнтерол. 35 : 732-736. [PubMed] [Google Scholar]
8. Collin, P. 1999. Новые диагностические данные при глютеновой болезни. Анна. Мед. 31 : 399-405. [PubMed] [Google Scholar]
9. Коллин П., М. Маки, О. Кейрилайнен, О. Холлстром, Т. Реунала и А. Пастернак. 1992. Селективный дефицит IgA и глютеновая болезнь. Сканд. Дж. Гастроэнтерол. 27 : 367-371. [PubMed] [Google Scholar]
10. Cunningham-Rundles, C. 2001. Физиология IgA и недостаточности IgA. Дж. Клин. Иммунол. 21 : 303-309. [PubMed] [Google Scholar]
11. Делонг, Э. Р., Д. М. Делонг и Д. Л. Кларк-Пирсон. 1988. Сравнение площадей под двумя или более коррелированными кривыми рабочих характеристик приемника: непараметрический подход. Биометрия 44 : 837-845. [PubMed] [Google Scholar]
Биометрия 44 : 837-845. [PubMed] [Google Scholar]
12. Дитрих В., Т. Энис, М. Бауэр, П. Доннер, У. Вольта, Э. О. Рикен и Д. Шуппан. 1997. Идентификация тканевой трансглютаминазы как аутоантигена целиакии. Нац. Мед. 3 : 797-801. [PubMed] [Google Scholar]
13. Farrell, RJ, and CP Kelly. 2002. Литник чревный. Н. англ. Дж. Мед. 346 : 180-188. [PubMed] [Google Scholar]
14. Feighery, L., C. Collins, C. Feighery, N. Mahmud, G. Coughlan, R. Willoughby, and J. Jackson. 2003. Антитела к трансглютаминазе и серологическая диагностика целиакии. бр. Дж. Биомед. науч. 60 : 14-18. [PubMed] [Google Scholar]
15. Ханссон Т., И. Дальбом, Дж. Холл, А. Хольц, Л. Эльфман, А. Даннеус и Л. Клареског. 2000. Реактивность антител против трансглютаминазы тканей человека и морской свинки у детей с глютеновой болезнью. Дж. Педиатр. Гастроэнтерол. Нутр. 30 : 379-384. [PubMed] [Google Scholar]
Нутр. 30 : 379-384. [PubMed] [Google Scholar]
16. Hansson, T., I. Dahlbom, S. Rogberg, A. Dannaeus, P. Hopfl, H. Gut, W. Kraaz, and L. Klareskog. 2002. Рекомбинантная трансглютаминаза тканей человека для диагностики и последующего наблюдения за целиакией у детей. Педиатр. Рез. 51 : 700-705. [PubMed] [Google Scholar]
17. Koistinen, J. 1975. Селективный дефицит IgA у доноров крови. Вокс Санг. 29 : 192-202. [PubMed] [Google Scholar]
18. Корпонай-Сабо, И. Р., И. Дальбом, К. Лаурила, С. Коскинен, Н. Вулли, Дж. Партанен, Дж. Б. Ковач, М. Маки и Т. Ханссон. 2003. Повышение уровня антител IgG к тканевой трансглютаминазе как диагностический инструмент для целиакии при селективном дефиците IgA. Кишка 52 : 1567-1571. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Korponay-Szabo, I.R., JB Kovacs, M. Lorincz, G. Goracz, K. Szabados и M. Balogh. 1997. Проспективное значение положительного результата на антитела к эндомизиуму при впоследствии верифицированной глютеновой болезни. Дж. Педиатр. Гастроэнтерол. Нутр. 25 : 56-63. [PubMed] [Google Scholar]
Szabados и M. Balogh. 1997. Проспективное значение положительного результата на антитела к эндомизиуму при впоследствии верифицированной глютеновой болезни. Дж. Педиатр. Гастроэнтерол. Нутр. 25 : 56-63. [PubMed] [Google Scholar]
20. Кумар В., М. Ярзабек-Хоржельска, Дж. Сулей, К. Карневска, Т. Фаррелл и С. Яблонска. 2002. Целиакия и дефицит иммуноглобулина А: насколько эффективны серологические методы диагностики? клин. Диагн. лаборатория Иммунол. 9 : 1295-1300. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Леон Ф., К. Камареро, Р. Пенья, П. Эйрас, Л. Санчес, М. Барагано, М. Ломбардия, А. Бутелло, и Г. Рой. 2001. Анти-трансглютаминазный IgA ELISA: клинический потенциал и недостатки в диагностике целиакии. Сканд. Дж. Гастроэнтерол. 36 : 849-853. [PubMed] [Google Scholar]
22. Льоренте, М. Дж., М. Себастьян, М. Дж. Фернандес-Асенеро, С. Прието, С. Вильянуэва и Г. Прието. 2004. Антитела IgA против тканевой трансглютаминазы в диагностике глютеновой болезни: соответствие биопсии кишечника у детей и взрослых. клин. хим. 50 : 451-453. [PubMed] [Google Scholar]
Вильянуэва и Г. Прието. 2004. Антитела IgA против тканевой трансглютаминазы в диагностике глютеновой болезни: соответствие биопсии кишечника у детей и взрослых. клин. хим. 50 : 451-453. [PubMed] [Google Scholar]
23. Лок, Р. Дж. и Д. Дж. Ансворт. 1999. Выявление дефицита иммуноглобулина А у детей и взрослых не обязательно помогает в серологической диагностике целиакии. Дж. Педиатр. Гастроэнтерол. Нутр. 28 : 81-83. [PubMed] [Академия Google]
24. Маки М., К. Мусталахти, Дж. Кокконен, П. Кулмала, М. Хаапалахти, Т. Карттунен, Дж. Илонен, К. Лаурила, И. Дальбом, Т. Ханссон, П. Хопфл, и М. Книп. 2003. Распространенность глютеновой болезни среди детей в Финляндии. Н. англ. Дж. Мед. 348 : 2517-2524. [PubMed] [Google Scholar]
25. Мейни А., Н. М. Пиллан, В. Вилланаччи, В. Монафо, А. Г. Угацио и А. Плебани. 1996. Распространенность и диагностика целиакии у детей с дефицитом IgA. Анна. Аллергия Астма Иммунол. 77 : 333-336. [PubMed] [Google Scholar]
Анна. Аллергия Астма Иммунол. 77 : 333-336. [PubMed] [Google Scholar]
26. Пикарелли А., М. ди Тола, Л. Саббателла, А. Мастраккио, А. Трекка, Ф. Габриэлли, Т. ди Виолончель, М. К. Анания и А. Торсоли . 2001. Идентификация новой подгруппы целиакии: антиэндомизиальные и анти-трансглютаминазные антитела класса IgG при отсутствии селективного дефицита IgA. Дж. Стажер. Мед. 249 : 181-188. [PubMed] [Google Scholar]
27. Prince, H. E., G. L. Norman, and W. L. Binder. 2000. Дефицит иммуноглобулина А (IgA) и альтернативные антитела, связанные с глютеновой болезнью, в сыворотке, переданной в референс-лабораторию для тестирования эндомизиального IgA. клин. Диагн. лаборатория Иммунол. 7 : 192-196. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Сблаттеро, Д., Ф. Флориан, Э. Аццони, Т. Зила, М. Парк, В. Балдас, Т. Нот, А. Вентура, А. Брэдбери и Р. Марзари. 2002. Анализ тонкой специфичности антител к целиакии с использованием фрагментов тканевой трансглутаминазы. Евро. Дж. Биохим. 269 : 5175-5181. [PubMed] [Google Scholar]
Анализ тонкой специфичности антител к целиакии с использованием фрагментов тканевой трансглутаминазы. Евро. Дж. Биохим. 269 : 5175-5181. [PubMed] [Google Scholar]
29. Seissler, J., U. Wohlrab, C. Wuensche, WA Scherbaum, and B.O. Boehm. 2001. Аутоантитела пациентов с глютеновой болезнью распознают различные функциональные домены аутоантигенной тканевой трансглютаминазы. клин. Эксп. Иммунол. 125 : 216-221. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Соллид, Л. М. 2002. Целиакия: анализ сложного воспалительного заболевания. Нац. Преподобный Иммунол. 2 : 647-655. [PubMed] [Google Scholar]
31. Сулканен С., Т. Халттунен, К. Лаурила, К. Л. Колхо, И. Р. Корпонай-Сабо, А. Сарнесто, Э. Савилахти, П. Коллин и М. Маки. 1998. Иммуноферментный анализ на тканевые трансглютаминазные аутоантитела в выявлении глютеновой болезни. Гастроэнтерология 115 : 1322-1328.