Содержание
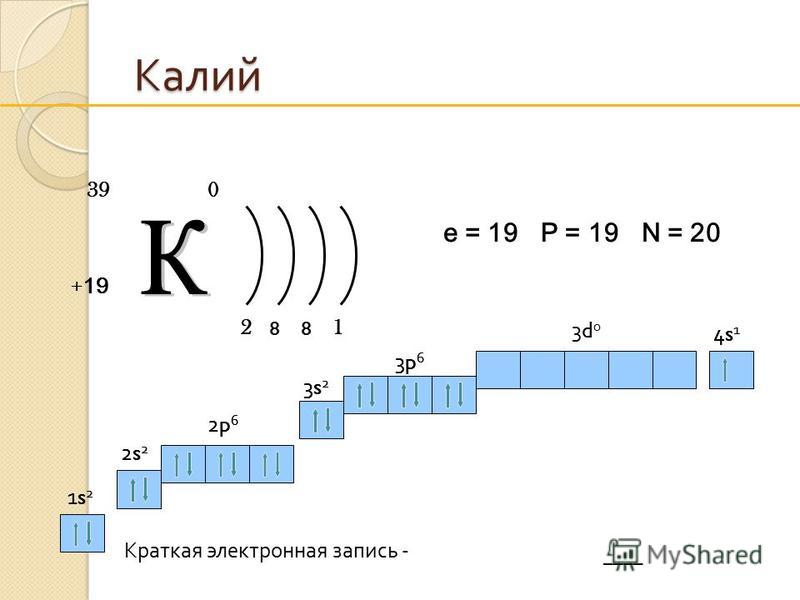
Калий
|
| |
|---|---|
|
Атомный номер |
|
|
Внешний вид простого вещества |
|
|
Свойства атома | |
|
Атомная масса (молярная масса) |
|
|
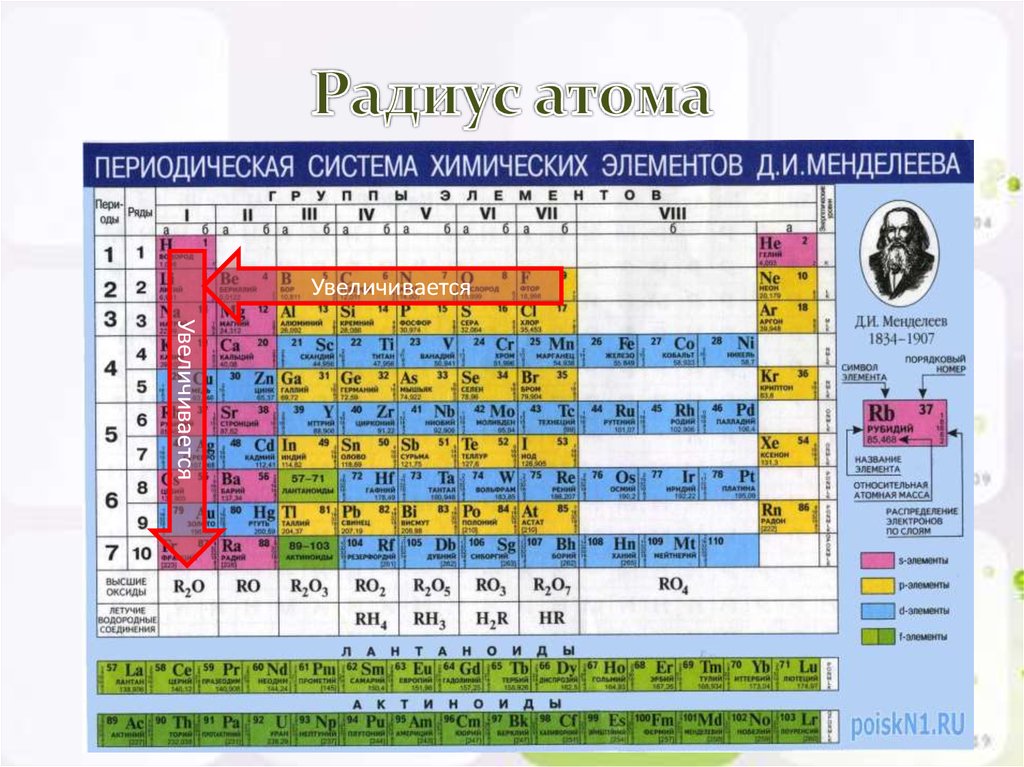
Радиус атома |
|
|
Энергия ионизации (первый электрон) |
|
|
Электронная конфигурация |
|
|
Химические свойства | |
|
Ковалентный радиус |
|
|
Радиус иона |
|
|
Электроотрицательность (по Полингу) |
|
|
Электродный потенциал |
|
|
Степени окисления |
|
|
Термодинамические свойства простого вещества | |
|
Плотность |
|
|
Молярная теплоёмкость |
|
|
Теплопроводность |
|
|
Температура плавления |
|
|
Теплота плавления |
|
|
Температура кипения |
|
|
Теплота испарения |
|
|
Молярный объём |
|
|
Кристаллическая решётка простого вещества | |
|
Структура решётки |
|
|
Параметры решётки |
|
|
Отношение c/a |
— |
|
Температура Дебая |
|
|
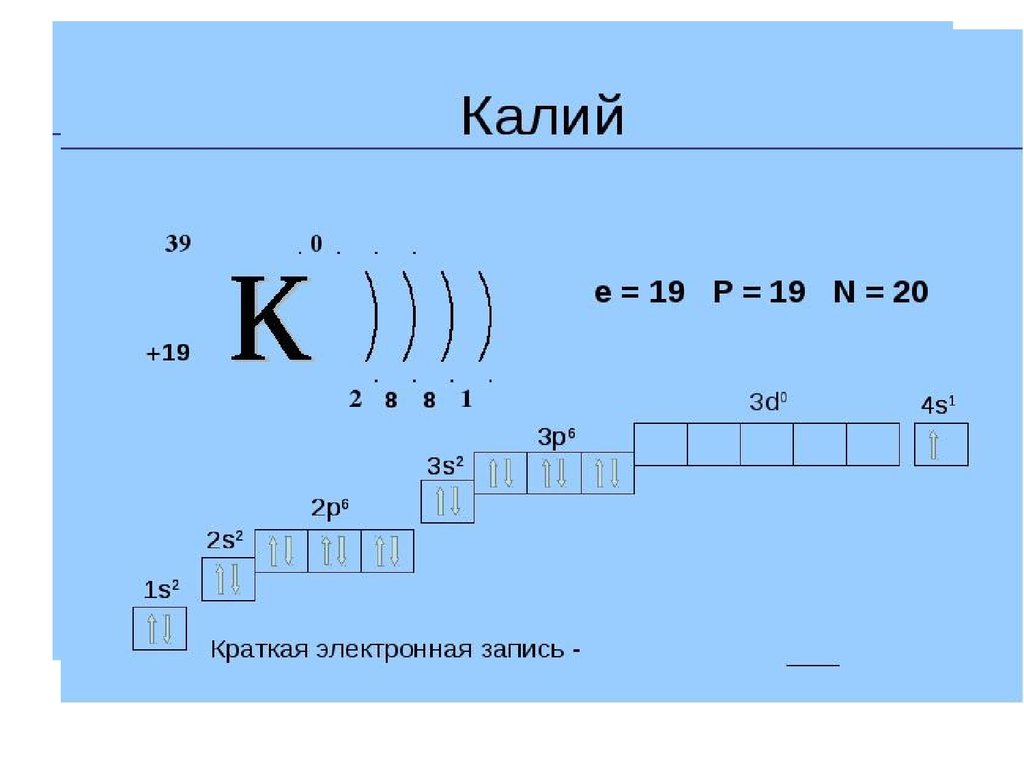
K |
19 |
|
39,0983 | |
|
4s1 | |
|
Калий | |
Калий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Присутствие в природе калия
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Калий — получение калия
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K+ + e− → K
2Cl− − 2e− → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH− − 4e− → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства калия
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства калия
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH. Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими как вода (реакция проходит со взрывом), различные оксиды и соли. В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
Оксиды калия и пероксиды калия
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксиды калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г воды составляет 112 г.
Применение калия
-
Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.
-
Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений. -
Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
Фиолетовый цвет пламени ионов калия в пламени горелки
-
Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы. -
Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов. -
Карбонат калия (поташ) — используется как удобрение, при варке стекла. -
Хлорид калия (сильвин, «калийная соль») — используется как удобрение. -
Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
-
Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике. -
Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина. -
Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода. -
Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика. -
Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике. -
Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
-
Фтороборат калия — важный флюс для пайки сталей и цветных металлов. -
Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали. -
Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса.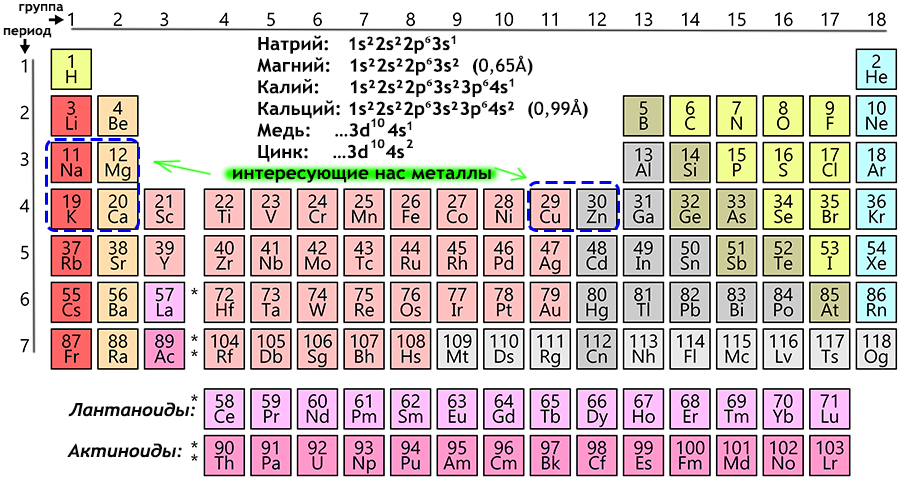
Калий и натрий между собой функционально связаны и выполняют следующие функции:
-
Создание условий для возникновения мембранного потенциала и мышечных сокращений. -
Поддержание осмотической концентрации крови. -
Поддержание кислотно-щелочного баланса. -
Нормализация водного баланса. -
Обеспечение мембранного транспорта. -
Активация различных ферментов. -
Нормализация ритма сердца.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1800 до 5000 миллиграмм. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Калия достаточно много в рыбе и молочных продуктах.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин В6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Электронная оболочка
Изотопы калия
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251×109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Дополнительная информация
Соединения калия
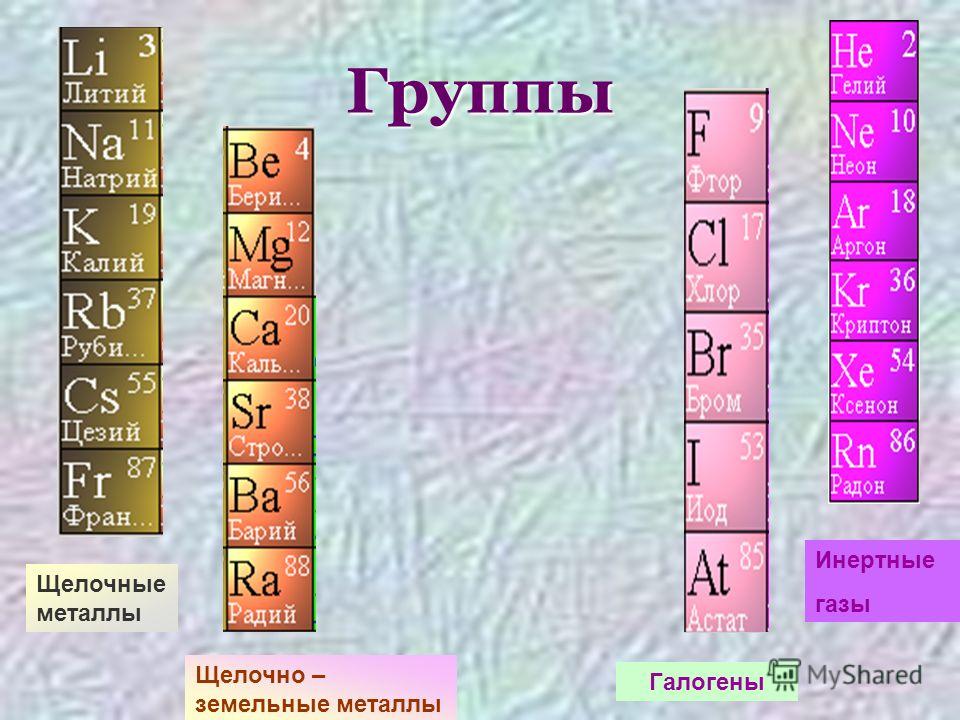
Щелочные металлы
Натрий, по химическим свойствам очень схожий с калием
— При помощи аналитического лабораторного оборудования, лабораторных и промышленных электродов, в частности: электродов сравнения ЭСр-10101 анализирующих содержание Cl— и К+.
Роль калия в жизни растений — Fitofert Россия
Калий наряду с азотом и фосфором относятся к главным элементам питания растений. Этот важный компонент помогает регулировать водный баланс растений через корни (осмотический градиент) и функционирование устьиц листа. Калий способствует накоплению крахмала и сахара в плодах, увеличивает сопротивляемость растений грибковым и микробным заболеваниям и повреждению насекомыми, и играет важную роль в десятках метаболических реакций, активизируя, по меньшей мере, 60 различных ферментов, участвующих в росте растений, фотосинтезе, в каждом из этапов синтеза белка и обмене веществ в целом. Данный элемент противодействует соляному стрессу от ионов натрия, т.к. калий конкурирует с ним за поглощение корнями.
Этот важный компонент помогает регулировать водный баланс растений через корни (осмотический градиент) и функционирование устьиц листа. Калий способствует накоплению крахмала и сахара в плодах, увеличивает сопротивляемость растений грибковым и микробным заболеваниям и повреждению насекомыми, и играет важную роль в десятках метаболических реакций, активизируя, по меньшей мере, 60 различных ферментов, участвующих в росте растений, фотосинтезе, в каждом из этапов синтеза белка и обмене веществ в целом. Данный элемент противодействует соляному стрессу от ионов натрия, т.к. калий конкурирует с ним за поглощение корнями.
Адекватные уровни калия повышают производство и транспортировку углеводов в растении. Серьезный дефицит калия тормозит передачу сахаров внутри растения, приводя к аккумуляции крахмала в нижних листьях. Калий также играет важную роль в повышении устойчивости растений к низким температурам, засолению, засухе и болезням. Поэтому растению необходимо подавать достаточное количество калия для удовлетворения потребностей во всех его частях.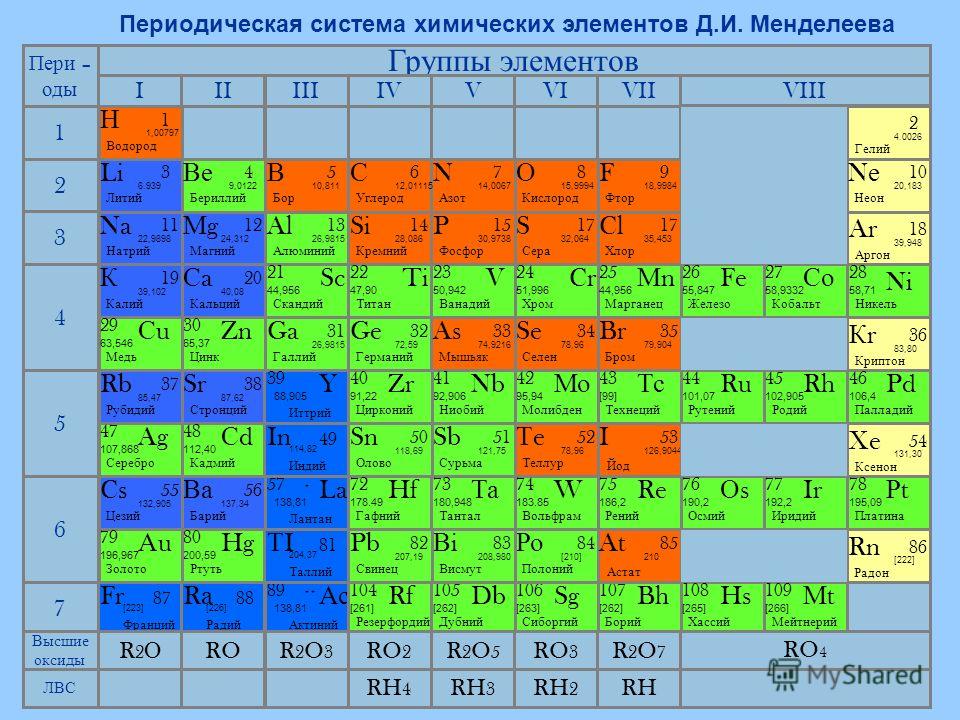
Внесение достаточного количества калия, который поддерживает листву в хорошем состоянии по мере роста растения положительным образом влияет на урожай и на содержание растворимых веществ в плодах (больше сахара) на момент сбора урожая. Более 50% всего потребленного объема калия растением в конечном итоге оказывается в плодах (Таблица 1). Действие, которое оказывает калий на синтез протеинов, усиливает преобразование потребленного нитрата в белки, что способствует эффективному усвоению применяемых азотных удобрений.
Таблица 1. Аккумуляция питательных элементов в сухом веществе различных частей растения перца в % от выноса элементов.
Части растения | Содержание элементов в % от сухого вещества | ||||
N | P | K | Ca | Mg | |
| Ликвидный урожай | 50 | 60 | 50 | 15 | 25 |
| Завязь плодов | 7 | 9 | 7 | 3 | 5 |
| Всего генеративные части растения | 57 | 69 | 57 | 18 | 30 |
| Листва | 25 | 17 | 21 | 60 | 45 |
Стебель | 13 | 10 | 18 | 17 | 21 |
Корни | 5 | 4 | 4 | 5 | 4 |
Всего вегетативные части растения | 43 | 31 | 43 | 82 | 70 |
ВСЕГО по растению | 100 | 100 | 100 | 100 | 100 |
Калий это катион, который вовлечен в поддержание осмотического потенциала растений (клеточный тургор), одним из следствий этого является движения устьиц — отверстий, которые позволяют растениям обмениваться газом и водой с атмосферой. Это позволяет растениям регулировать необходимый водный баланс в условиях стресса, таких как высокое содержание солей и дефицит воды. Действительно, растения с высоким содержанием калия обычно более эффективно используют воду, то есть потребляют сравнительно меньше воды для производства того же количества биомассы, чем растения для которых характерен дефицит калия.
Это позволяет растениям регулировать необходимый водный баланс в условиях стресса, таких как высокое содержание солей и дефицит воды. Действительно, растения с высоким содержанием калия обычно более эффективно используют воду, то есть потребляют сравнительно меньше воды для производства того же количества биомассы, чем растения для которых характерен дефицит калия.
Кроме того калий оказывает влияние на процесс созревания плодов, а именно на синтез пигмента ликопина, который отвечает за красный цвет плодов.
Рисунок 1. Калий усиливает транспорт и хранение продуктов фотосинтеза от листьев к плодам, как показано на рисунке на примере томата.
Калий в почве
Калий, находящийся в почве с точки зрения доступности для растения, можно классифицировать по следующим категориям:
- Недоступный калий
- Связанный частичками почвы или медленно доступный калий
- Обменный калий или готовый к поглощению калий
- Калий в почвенном растворе
Основа вышеназванной классификации – это его доступность для растений. В зависимости от типа почвы и условий окружающей среды, доступность калия может изменяться.
В зависимости от типа почвы и условий окружающей среды, доступность калия может изменяться.
Недоступный калий – находится в виде кристаллов в глиняных жилках почвы, минералов, слюды, которые являются частями почвенной структуры. Растения не могут потреблять данный вид калия в данной нерастворимой форме. Однако, со временем, данные минералы распадаются, и небольшое количество калия переходит в почвенный раствор.
Связанный частичками почвы калий – данный вид калия медленно высвобождается в течение сезона выращивания. Глиняные минералы почвы имеют тенденцию фиксировать калий. В процессе переувлажнения и пересыхания почвы, калий попадает в ловушку между частичками глины (глиняные минералы имеют слоистую структуру). Как только почва увлажняется, некоторые из ионов калия высвобождаются в почвенный раствор. Медленно высвобождаемый калий обычно не подлежит измерению при проведении стандартного анализа почвы.
Обменный калий – доступный для растения калий, который растение может потреблять сразу.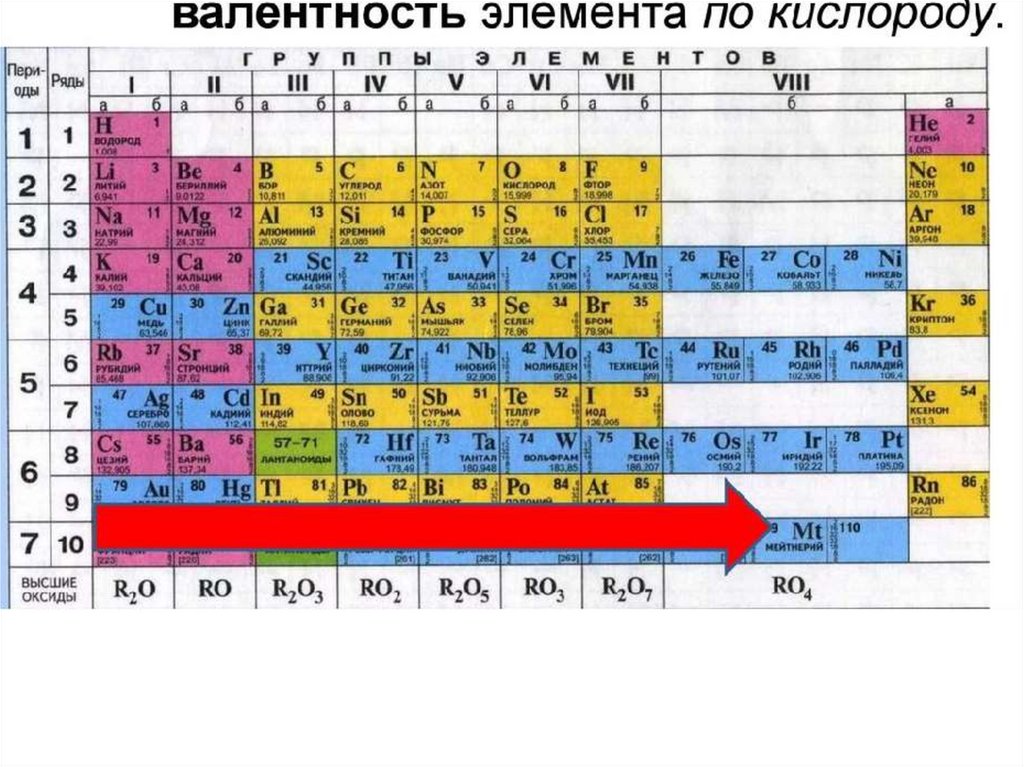 Данная фракция калия находится на поверхности частичек глины и органических веществ в почве. Он находится в равновесии с почвенным раствором и легко высвобождается, когда растения поглощают калий из почвенного раствора. Обменный калий измеряется при проведении большинства анализах почвы.
Данная фракция калия находится на поверхности частичек глины и органических веществ в почве. Он находится в равновесии с почвенным раствором и легко высвобождается, когда растения поглощают калий из почвенного раствора. Обменный калий измеряется при проведении большинства анализах почвы.
Калий в почвенном растворе – растворенный калий в почвенном растворе и готовый к абсорбции растением. Это самый маленький резервуар его потребления. Поэтому его анализ в почвенном растворе не дает адекватную картину нахождения данного элемента в почве, доступного для растений.
Фракции калия в почве
Факторы, влияющие на доступность калия в почве.
На доступность калия для растений в почве влияют несколько факторов:
- Уровень кислорода – кислород необходим для надлежащего функционирования корневой системы, включая поглощение калия.
- Влажность – чем больше влаги в почве, тем лучше калий усваивается растениями.
- Обработка почвы — исследование показало, что регулярно обрабатываемая почва позволяет лучше поглощать калий.

- Температура почвы – 15-27°С являются идеальными условиями активности корневой системы и большинства физиологических процессов в растении. Чем ниже температуры, тем ниже абсорбция.
Все основные катионы: кальций, магний, калий и натрий конкурируют друг с другом за поглощения клетками корней. Поэтому вносить их необходимо в сбалансированных пропорциях. Например, внесение чрезмерных доз извести может привести к формированию дефицита магния, перенасыщение калием также приводит к дефициту магния, либо замещает кальций в растениях, создавая тем самым множество проблем и т.д. Чрезмерный натрий замещает калий, что приводит к ряду проблем для растения. Правильное соотношение калия и магния является пропорция 4 :1.
Рисунок 2: Доступность калия через корни растения в зависимости от рН почвенного раствора
Исследования показали, что увеличения нормы содержания калия в период налива и созревания плодов приводит к следующим эффектам:
- Увеличение количество плодов и их веса
- Утолщение стенок плодов
- Улучшение качественных характеристик плодов
Калий увеличивает сопротивляемость растений к заболеваниям.
Калий оказывает хорошо известный эффект повышения устойчивости растений к патогенам и снижения воздействия инфекции:
- Калий снижает эффект бактериоза (пятнистость листьев), вызываемый Pseudomonas lachrymans.
- У партенокарпических тепличных огурцов за счет применения дополнительных доз калия на 27% — 33% снижается серая плесень плодов, вызываемая Botrytis cinerea.
- Листовые обработки солями калия помогают контролировать мучнистую росу, вызываемую Sphaerotheca fuliigiena (Фото 2).
Листовые подкормки нитратом калия помогают растению огурца вырабатывать индивидуальную сопротивляемость к заболеванию.
Фото 2 A: Сверху: лист огурца, инфицированный мучнистой росой.
Фото 2 B: Лист с соседнего растения, обработанного удобрением с содержанием калия.
Дефицит калия
Первичные симптомы дефицита калия на листьях проявляется в виде их окрашивания в темно-зеленый или голубоватый цвет. Листья приобретают чуть блестящую поверхность. Между прожилок листа проявляются пятна ярко-зеленого цвета. У больших листьев края начинают закручиваться вниз в тонкие листочки. На них появляются морщины, а верхняя (адаксиальная) поверхность листа становится коричневой, тогда как обратная сторона листа (абаксиальная) имеет россыпь коричневых точек, похожих на симптомы ранней гнили.
Листья приобретают чуть блестящую поверхность. Между прожилок листа проявляются пятна ярко-зеленого цвета. У больших листьев края начинают закручиваться вниз в тонкие листочки. На них появляются морщины, а верхняя (адаксиальная) поверхность листа становится коричневой, тогда как обратная сторона листа (абаксиальная) имеет россыпь коричневых точек, похожих на симптомы ранней гнили.
Фото 3. Пример дефицита калия на ботве картофеля.
Растения картофеля с дефицитом калия растут медленнее, для них характерна более мелкая листва с неравномерной ребристой поверхностью (Фото 3). Растение приобретает темно-зеленый цвет, чуть позже кромка листа становится бронзовой и желтоватой и данный хлороз распространяется почти на всю поверхность листа.
На землянике первые симптомы дефицита калия проявляются на верхних жилках старых (нижних) листьев. Кончики зубцов краснеют, повреждение постепенно прогрессирует внутрь листа между прожилок до тех пор, пока не затрагивается большая часть листовой пластины.
Фото 4. Дефицит калия на листьях земляники с усугублением симптомов по мере старения листа.
Фото 5. Типичное проявление дефицита калия на листьях огурца.
Образование коричневых пятен (некрозов) связано с нарушением азотного обмена и образованием в тканях яда разложения — путресцина. Дефицит калия также влияет на качество плодов. Плоды деформируются, могут плохо окрашиваться, становятся рыхлыми и безвкусными.
Калий является мобильным элементом в растении и в условиях недостатка движется только к более молодым листьям. Хотя рост растений, испытывающих дефицит калия, не может быть серьезно нарушен, однако урожайность и качество плодов значительно снижаются. Плод не расширяется и не вытягивается в полной мере, а его кончик разбухает, что также может указывать на симптом водного стресса.
Фото 6. Деформация плода из-за набухания кончика.
Решение проблемы
- В средние или тяжелые почвы, где движение калия затруднено, перед посадкой необходимо внести нитрат калия.
 Определение необходимой нормы внесения должно основываться на анализе почвы.
Определение необходимой нормы внесения должно основываться на анализе почвы. - В песчаных почвах, где калийные удобрения продвигаются быстрее, внесение водорастворимых макроудобрений в почву, как правило, помогают быстрой коррекции дефицита калия.
- Дефицит калия может быть быстро откорректирован через систему капельного полива (фертигацию).
- Эффективным методом также можно считать листовые подкормки калиевыми препаратами в течение короткого периода времени.
- Для культур, выращиваемых на гидропонике, используют питательный раствор, содержащий 150-200 мг/л K.
Избыток калия
Растения из доступных ему питательных веществ предпочтительно поглощает ионы калия. При чрезмерном внесении калия резко сокращается поглощение, прежде всего магния и кальция. Поэтому на почвах, переудобренных калием, плоды часто страдают от дефицита кальция, а на листьях возникают признаки недостатка магния. Когда калий для растений находится в избытке, в почве затрудняется также и поглощение растением микроэлементов.
Такие физиологические нарушения, как побурение мякоти, побурение сердечка и загнивание чечевичек, а также преждевременное опадение листьев и др. часто считают следствием чрезмерного удобрения калием.
Особенно опасно излишнее количество калия на фоне недостатка азота и фосфора.
Калийные удобрения лучше вносить несколько раз малыми дозами, чем один раз в большой концентрации. Кроме того, следует знать, что калий действует на растение лучше, если удобрение внесено во влажную почву при прохладной погоде.
Определить потребность калия для растений можно в известной степени на основании данных почвенного анализа. Примерные дозы калийных удобрений при недостаточном содержании калия в почве равны 150—200 кг/га К2О, при нормальном — 100—150 кг/га К2О; при избыточном содержании калий не вносят.
Калийные удобрения
Основными источниками калия являются: нитрат калия, сульфат калия, сульфат калия-магния и хлорид калия. Самый быстрый источник в доступной для растения форме это калиевая селитра.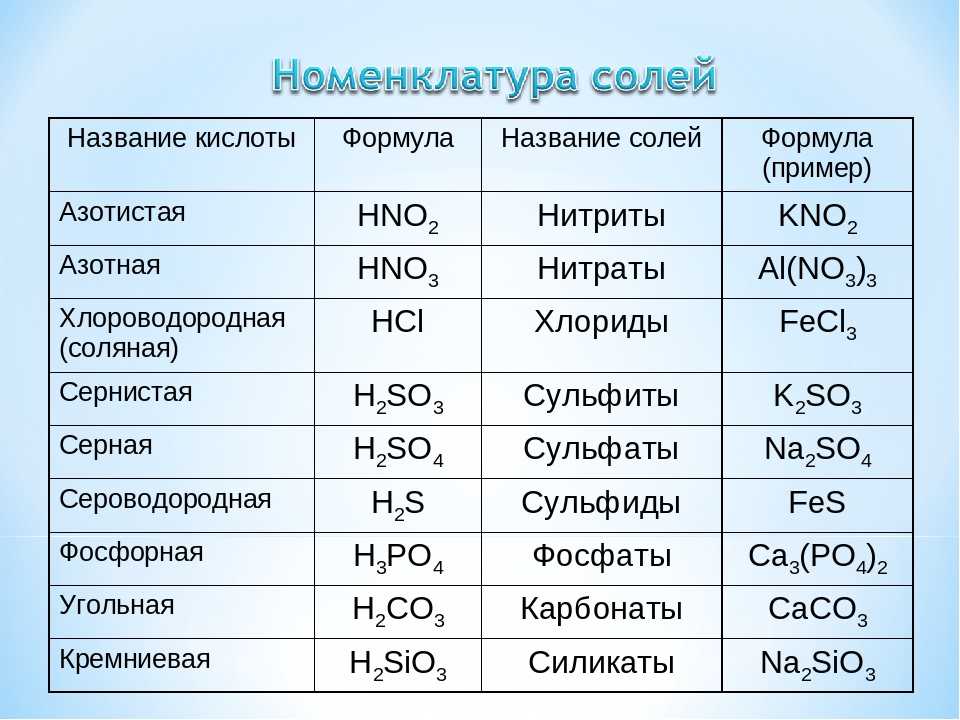 Данное удобрение является идеальным удобрением на стадии налива плодов. Из-за своей хорошей мобильности он может быть потреблен растением через час после внесения в почву. Благодаря своему взаимодействию с ионами (нитратами) он также важен на данной стадии развития, он требует минимального количества влаги в почве для растворения и доступности растения. Другие источники калия имеют преимущество из-за более низкой стоимости, однако они имеют и свои недостатки.
Данное удобрение является идеальным удобрением на стадии налива плодов. Из-за своей хорошей мобильности он может быть потреблен растением через час после внесения в почву. Благодаря своему взаимодействию с ионами (нитратами) он также важен на данной стадии развития, он требует минимального количества влаги в почве для растворения и доступности растения. Другие источники калия имеют преимущество из-за более низкой стоимости, однако они имеют и свои недостатки.
Например, сульфат калия имеет более низкую растворимость, чем нитрат калия. Второй пример: хлорид калия поставляет большое количество хлоридов, которые в больших дозах являются токсичными для растений. Учитывая негативное влияние хлора на культуры, хлористый калий вносят в грунт только на зиму, перед вспашкой.
Третий вариант: калимагнезия (сульфат калия-магния) слишком медленно преобразуется в доступную форму. Из-за перечисленных особенностей рекомендуется использовать данные источники калия в небольших количествах или только на начальных этапах развития растения, чтобы обеспечить переход удобрений в доступную форму и избежать накопления токсичности из-за хлоридов. Кроме того почва должна получить достаточное количество осадков для вымывания хлоридов, которые могут навредить растению.
Кроме того почва должна получить достаточное количество осадков для вымывания хлоридов, которые могут навредить растению.
Один из основных недостатков наличия хлоридов в почве это их конкуренция с ионами нитратов, фосфатов и сульфатов за вход в растение; чем больше хлоридов проникает в растение, тем меньше других анионов попадет в растение. Хлориды также повышают общий уровень солей в почве и поэтому повышают уровень ЕС. При достижении определенного уровня засоленности, уровень потребление растением воды снижается. Данный феномен может привести к повышению стресса из-за снижения влажности почвы в результате чего размер плодов уменьшаются, а урожайность, соответственно, снижается.
Таблица 2. Характеристики калийных удобрений.
| Общее название | Формула | Характеристики |
| Калиевая селитра | KNO3 | Является идеальным калийным удобрением на всех этапах роста, также является частичным источником нитратного азота для растения. Имеет высокую растворимость 320 г/л при 20°С. Имеет высокую растворимость 320 г/л при 20°С. |
| Сульфат калия | K2SO4 | Является идеальным калийным удобрением на поздней стадии роста, когда растению не требуется азот. Сульфат калия имеет ограниченную растворимость около 6% (при смешивании с другими удобрениями). |
| Бикарбонат калия | К(НСО3)2 | Используется в основном как регулятор рН для его повышения. |
| Хлорид калия | KCl | Хлориды не рекомендуется широко использоваться для культур, т.к. они чувствительны к высокому содержанию солей в корневой зоне. Использование хлористых удобрений приводит к конкуренции в корневой зоне между анионами (NO3—, h3PO4—,SO42-), что в конечном итоге приводит к нарушению баланса питательных веществ.
|
Еще раз перечислим основные функции калия и эффект его внесения.
При достаточном поступлении калия в растение:
- Процессы окисления в клетках идут интенсивнее
- Усиливается клеточный обмен
- Растение легче переносит недостаток влаги
- Фотосинтез ускоряется
- Возрастает ферментативная активность
- Легче проходит обмен белков и углеводов
- Растения быстрее адаптируются к отрицательным температурам
- Образуется больше органических кислот
- Повышается сопротивляемость к патогенным факторам
При нехватке калия:
- Из простых углеводов не синтезируются сложные
- Образование белка в клетках прекращается.

- Происходит задержка в развитии репродуктивных органов.
- Стебель становится слабым.
Все вышеперечисленные факторы прямо или косвенно влияют на формирование плодов и их качества, а значит и на вашу прибыль!
Линейка комплексных водорастворимых NPK-удобрений ФИТОФЕРТ ЭНЕРДЖИ содержит сбалансированный состав всех основных элементов питания в зависимости от потребностей растений на каждом этапе его развития, способствуя их эффективному росту и развитию!
ФИТОФЕРТ ЭНЕРДЖИ 5-55-10 СТАРТ– на начальном этапе растение не нуждается в больших количествах калия, поэтому в данном удобрении он представлен в виде монофосфата калия. Соотношение активных K и P в препарате оптимально для максимального плодоношения, а также повышения стойкости растений к болезням, вредителям и заморозкам.
ФИТОФЕРТ ЭНЕРДЖИ 20-20-20 БАЛАНС – данное удобрение содержит сбалансированный состав по всем основным элементам, калий в нем представлен в виде быстродоступного нитрата калия и монофосфата калия.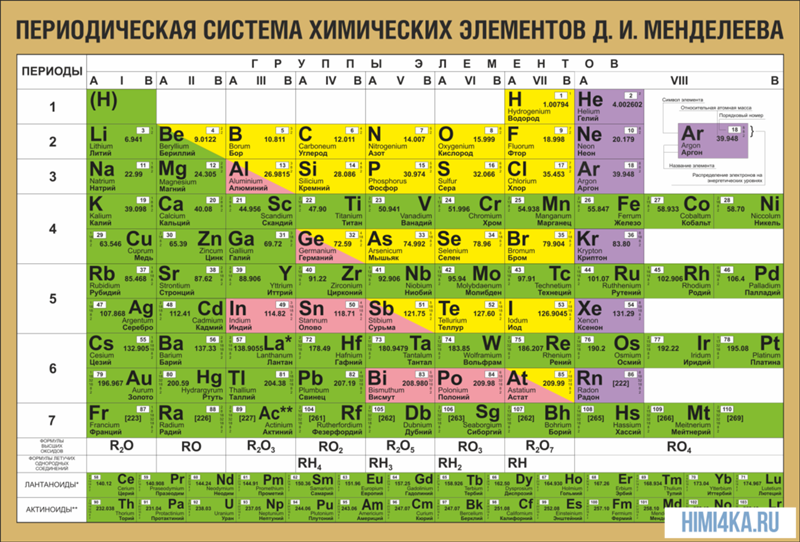
ФИТОФЕРТ ЭНЕРДЖИ 15-5-33 АКТИВ – на этапе налива плодов одним из основных элементов является калий, в состав данного удобрения входят 3 видов калийных удобрений, 50% нитрата калия, как самого быстрого и легкодоступного источника калия, 22% нитрата аммония, позволяющий получить калий в более отсроченное время, обеспечивая его непрерывную подачу, и монофосафата калия.
ФИТОФЕРТ ЭНЕРДЖИ 0-15-45 ФИНИШ – данное удобрение применяется на финальных этапах формирования подов – окрашивания и созревания, поэту нитратная форма калийных удобрений в нем исключена. В данном удобрении калий представлен в виде сульфата, которые способствуют созреванию плодов и монофосфата калия, когда растениям нужна дополнительная энергия, которую обеспечивает фосфор.
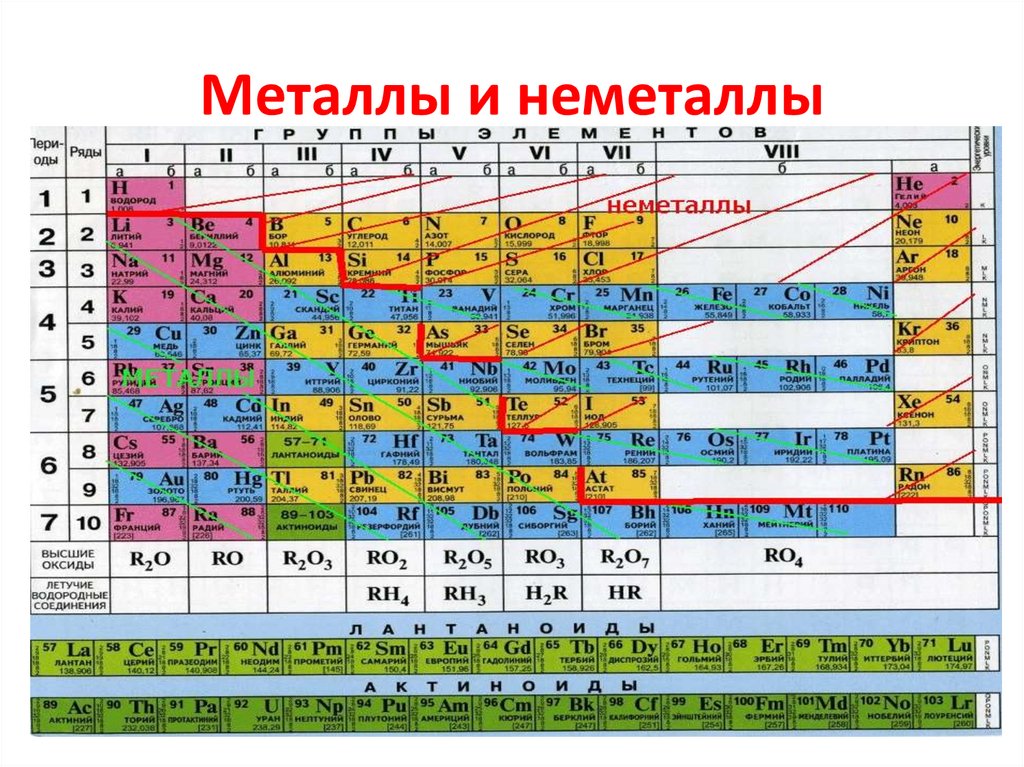
Нервный элемент Калий | Периодическая таблица
Знакомство с калием
Калий, обозначенный символом К, является одним из щелочных металлов. Этот элемент мягкий и имеет серебристо-белый цвет.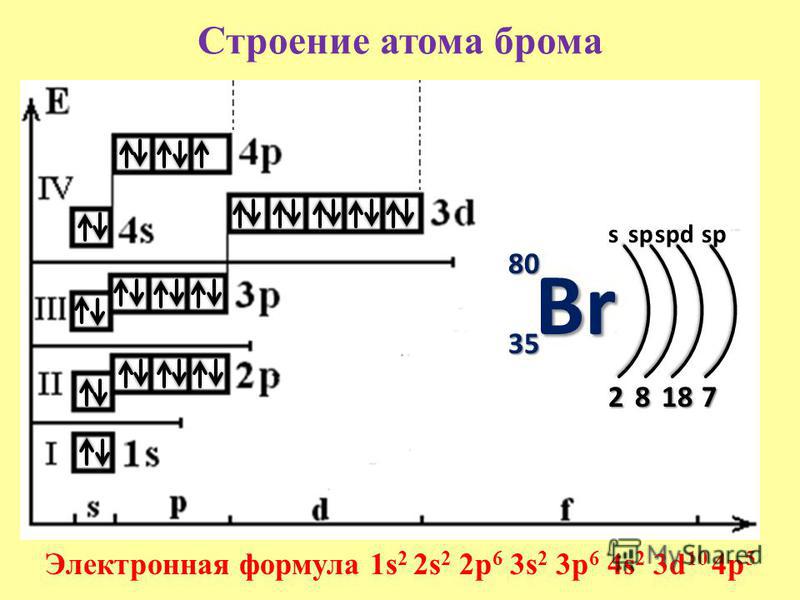 Как и другие щелочные металлы, калий в основном находится в форме солей. Кроме того, ионы калия необходимы для нормальной передачи нервных импульсов внутри живых клеток.
Как и другие щелочные металлы, калий в основном находится в форме солей. Кроме того, ионы калия необходимы для нормальной передачи нервных импульсов внутри живых клеток.
Десять интересных и забавных фактов о калии
- Калий был впервые выделен из поташа, золы растений, замоченной в горшке с водой. Название «калий» также происходит от «калий».
- Второй наименее плотный металл после лития — калий.
- Первым металлом, выделенным электролизом, был калий.
- Жиры могут реагировать с гидроксидом калия с образованием мыла.
- Калий имеет три основных изотопа, и один из изотопов 40 К является радиоактивным. 40 K содержится во всех элементах калия и является наиболее распространенным радиоизотопом в организме человека.
- Для правильного функционирования клеток необходимы ионы калия.
- Как дефицит, так и избыток калия могут вызывать серьезные симптомы.
- Бананы являются хорошим источником калия.
 Пять бананов или одиннадцать бананов обеспечат достаточное суточное количество калия. Однако слишком много бананов также приведет к ужасающим побочным эффектам.
Пять бананов или одиннадцать бананов обеспечат достаточное суточное количество калия. Однако слишком много бананов также приведет к ужасающим побочным эффектам. - Промышленная добыча калийных солей осуществляется из эвапоритовых отложений на дне древних озер, например, Мертвого моря.
- Удобрения используют соли калия в качестве источника питания растений.
Калий в периодической таблице
В периодической таблице калий (K) находится в группе 1 и периоде 4. Это щелочной металл с атомным номером 19.. Электронная конфигурация калия [Ar] 4s 1 . Как и другие щелочные металлы, он имеет один валентный электрон, который легко удаляется, образуя катион. Катионная форма калия соединяется с различными анионами с образованием солей.
Калий – влияние на здоровье
Калий необходим для функционирования живых клеток, поскольку он играет жизненно важную роль в нервных функциях и жидкостных системах человека. В нервной системе калий в его катионной форме помогает передавать сообщения между мозгом и телом. Эти сообщения представляют собой нервные импульсы, которые контролируют сердцебиение, мышечные сокращения и другие функции организма. Калий, перемещающийся из клетки, и натрий, входящий в клетку, создает изменение напряжения в клетке, что, в свою очередь, создает эти нервные импульсы. Следовательно, получение достаточного количества калия необходимо для поддержания здоровой функции нервов.
Эти сообщения представляют собой нервные импульсы, которые контролируют сердцебиение, мышечные сокращения и другие функции организма. Калий, перемещающийся из клетки, и натрий, входящий в клетку, создает изменение напряжения в клетке, что, в свою очередь, создает эти нервные импульсы. Следовательно, получение достаточного количества калия необходимо для поддержания здоровой функции нервов.
Люди могут получать калий из фруктов и овощей, включая картофель, бананы и белую фасоль; однако важно, чтобы уровень калия оставался в пределах нормы. Слишком много калия в крови может вызвать низкое кровяное давление или даже сердечный приступ. В качестве альтернативы дефицит калия приводит к таким симптомам, как судороги ног, паралич мышц, аномальное сердцебиение и т. д. Исследование показало, что для тех, кто находится в диапазоне калия от низкого до здорового, повышение уровня калия окажет значительное влияние на снижение артериального давления населения. . Кроме того, увеличение потребления калия может оказать прямое благотворное влияние на сердечно-сосудистую систему. Лучший способ увеличить потребление калия — увеличить потребление фруктов и овощей, которые также оказывают благотворное влияние на здоровье независимо от потребления калия.
Лучший способ увеличить потребление калия — увеличить потребление фруктов и овощей, которые также оказывают благотворное влияние на здоровье независимо от потребления калия.
Изотопы калия
Существует три основных изотопа калия: 39 К, 40 К и 41 К. Среди них только 40 К является радиоактивным. В общем, радиоактивный изотоп — это изотоп, ядра которого нестабильны и могут выделять энергию, спонтанно испуская излучение в виде альфа-, бета- и гамма-лучей.
40 K представляет большой интерес для ученых и составляет 0,012% от общего количества калия, встречающегося в природе. Калий широко распространен в природе, например, в растениях, животных и минералах, что означает радиоактивность 40 К присутствует в большинстве вещей вокруг нас, даже в человеческих телах. Однако его количества недостаточно, чтобы причинить какой-либо вред.
Радиоактивный 40 К в минералах помогает определить возраст объектов.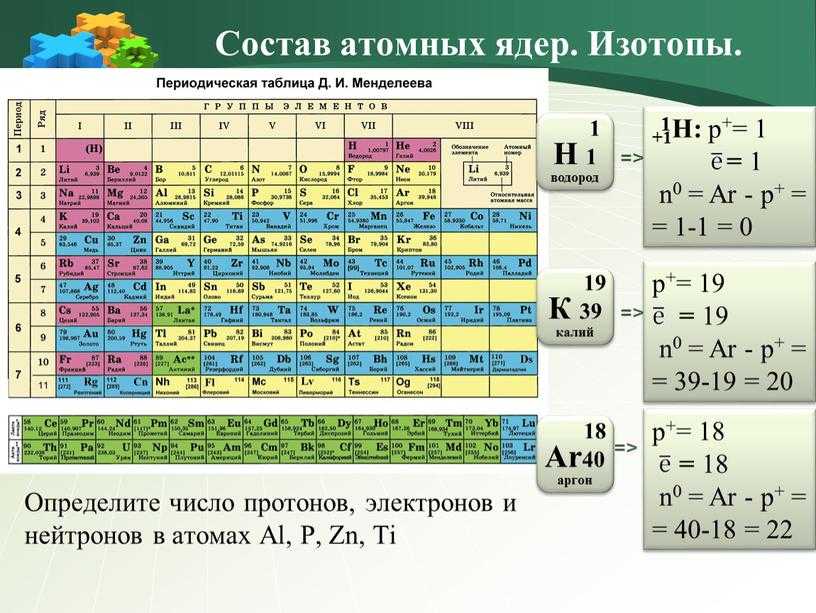 Если минерал содержит калий, при распаде 40 К образуется изотоп аргона, который будет заперт в минерале. Отношение между 40 К и 40 Ar указывает время, прошедшее с момента образования минерала. Чем старше камень, тем больше 40 Ar и менее 40 K содержит.
Если минерал содержит калий, при распаде 40 К образуется изотоп аргона, который будет заперт в минерале. Отношение между 40 К и 40 Ar указывает время, прошедшее с момента образования минерала. Чем старше камень, тем больше 40 Ar и менее 40 K содержит.
Применение калия в современном мире
Калий широко применяется в промышленности и в биологических целях, что доказывает его важность.
Промышленное применение
Калий-натриевый сплав (NaK) используется в качестве теплоносителя. Сильный щелочной гидроксид калия (KOH) образует мыло из жиров и масел и используется в реакциях гидролиза для получения сложных эфиров. Хлорат калия (KClO 3 ) необходим для производства безопасных спичек, а также используется в сельском хозяйстве в качестве эффективного средства для уничтожения сорняков.
Использование в качестве удобрения
В удобрениях используется калий, связанный ионами с хлоридом, нитратом и сульфатом. Он помогает поддерживать функции устьиц (регуляция воды) в растительных клетках и другие важные ферменты. И наоборот, без калия растения не в состоянии бороться с высокими температурами. Удивительно, но сельскохозяйственные удобрения потребляют 95% производимого калия, а около 90% калия поступает из KCl.
Он помогает поддерживать функции устьиц (регуляция воды) в растительных клетках и другие важные ферменты. И наоборот, без калия растения не в состоянии бороться с высокими температурами. Удивительно, но сельскохозяйственные удобрения потребляют 95% производимого калия, а около 90% калия поступает из KCl.
Элемент калия в организме человека
Калий является важным элементом для организма человека. В частности, ионы калия присутствуют в сочетании с широким спектром белков и ферментов. Это помогает поддерживать уровень кислотности и кровяное давление. Это преобладающий положительный ион внутри клеток человека, а натрий является основным положительным ионом вне клеток человека. Разница между концентрациями этих двух ионов внутри и снаружи может иметь значение в электрическом потенциале, который необходим для основных функций организма, таких как передача сигналов между нейронами (нейротрансмиссия), работа сердца и сокращение мышц.
История калия
Калий был первым металлом, выделенным электролизом. Впервые он был обнаружен сэром Хамфри Дэви из Англии в 1807 году. Он обнаружил крошечную каплю жидкого металла, образовавшуюся при электролизе небольшого количества расплавленного поташа, и назвал этот элемент «калием» на основе слова «калий».
Впервые он был обнаружен сэром Хамфри Дэви из Англии в 1807 году. Он обнаружил крошечную каплю жидкого металла, образовавшуюся при электролизе небольшого количества расплавленного поташа, и назвал этот элемент «калием» на основе слова «калий».
Калий Химия – соединения, реакции, степени окисления
Химические свойства калия
Как и другие щелочные металлы, калий очень реакционноспособен. Он может бурно реагировать с водой с образованием водорода (H 2 ) газ. Избыточное тепло, образующееся в результате этой реакции, вместе с H 2 в качестве продукта может быть взрывоопасным. Калий также может реагировать с воздухом и образовывать оксидные слои. Когда калий сгорает на воздухе, он может образовывать оранжевый супероксид калия в форме KO 2 . Калий также может быстро реагировать со всеми галогенами (F 2 , Cl 2 , I 2 ) с образованием галогенидов калия (KF, KCl, KBr).
youtube.com/embed/P-odJitHJAk?feature=oembed&enablejsapi=1&origin=https://chemistrytalk.org» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>
Соединения калия
Хлорид калия (KCl) является наиболее важным соединением калия. Искусственные удобрения максимально используют это соединение. Он не имеет запаха, имеет вид белых/бесцветных кристаллов и легко растворяется в воде. Другие соединения калия также имеют коммерческое значение:
- K 2 SO 4 : Сульфат калия представляет собой белый и твердый кристалл. Он негорюч и растворим в воде, но не в спирте. Он также служит удобрением, которое помогает растениям расти лучше.
- KHCO 3 : Пищевая сода или бикарбонат калия могут использоваться в качестве разрыхлителей, антацидов (при расстройстве желудка) и добавок в безалкогольные напитки.
- KHSO 3 : Бисульфит калия используется для консервирования пищевых продуктов, отбеливания текстиля и дубления кожи.
 Бисульфит калия представляет собой химическую смесь с приблизительной химической формулой KHSO 3 . Это не настоящее соединение, а смесь солей, которые дают растворы, состоящие из ионов калия и бисульфита.
Бисульфит калия представляет собой химическую смесь с приблизительной химической формулой KHSO 3 . Это не настоящее соединение, а смесь солей, которые дают растворы, состоящие из ионов калия и бисульфита. - KBr: Бромат калия используется при гравировке и в качестве добавки к хлебу. Это белый кристалл, растворимый в воде. В разбавленном водном растворе бромид калия имеет сладкий вкус. При более высоких концентрациях вкус не очень приятный.
- K 2 SiF 6 : Фторсиликат калия используется для специализированных стекол и керамики.
- KOH: Гидроксид калия , также называемый едким кали, имеет множество промышленных применений, включая средство для удаления краски, производство специального мыла, топливных элементов и аккумуляторов. Кроме того, как и NaOH, он служит источником OH 9.0018–, высоконуклеофильный анион, атакующий полярные связи в органических материалах.
- KNO 3 : Нитрат калия присутствует во взрывчатых веществах, фейерверках, спичках и ракетном топливе.

Выделение калия
Соли калия находятся в эвапоритовых отложениях на дне древних озер и морском дне. Добыча солей калия из этих обширных источников экономически выгодна. Основные типы источников калия — карналлиты, содержащие 45—85% карналлита и 18—50% галита с небольшими примесями сильвита, ангидрита, глинистых минералов и карбонатов; сильвинит в том числе 95–98% сильвита и галита, остальное нерастворимый остаток; и твердая соль, содержащая 8–25% сильвита, 18–30% кизерита, 40–60% галита и 0,5–2,0% карбонатов, ангидрита и глинистых минералов. Большинство известных ресурсов в СССР сосредоточено на Урале (Соликамск, Пермская область), Западном Казахстане, Западной Украине и Белоруссии. Значительные зарубежные месторождения включают месторождения в ГДР (Штассфурт), ФРГ (Ганновер, Гарц, Гессен, Баден), США (район Карлсбад в Нью-Мексико, озеро Серлз в Калифорнии), Канаде (Саскачеван). , Франция (Эльзас) и Италия (Сицилия).
Для отделения солей калия от соединений Na- и Mn можно применять несколько методов. В частности, фракционное осаждение является широко используемым методом выделения этих растворимых солей. И большая часть калия приобретается в виде хлорида калия (KCl) и используется в качестве удобрения.
В частности, фракционное осаждение является широко используемым методом выделения этих растворимых солей. И большая часть калия приобретается в виде хлорида калия (KCl) и используется в качестве удобрения.
Первый метод выделения
Сэр Хамфри Дэви впервые выделил чистый калий с помощью простого лабораторного химического эксперимента в 1807 году. Точнее, он применил электричество к расплавленной древесной золе в процессе, называемом электролизом. При электролизе древесной золы сначала готовят раствор, помещая древесную золу в металлическую посуду и нагревая золу с помощью горелки Бунзена. Зола, содержащая высокую концентрацию гидроксида калия (КОН), будет таять. Затем к каждому электроду батареи присоединяется провод, а выводы батареи помещаются в расплавленную золу до тех пор, пока вблизи анода не образуется жидкий металлический калий. Провод на положительной клемме служит анодом, а провод на отрицательной клемме — катодом. На аноде накапливается металлический калий.
Этот процесс электролиза также использовался в промышленности в 1920-х годах. Однако термический процесс взаимодействия натрия с хлоридом калия в равновесной химической реакции стал доминирующим промышленным методом.
Однако термический процесс взаимодействия натрия с хлоридом калия в равновесной химической реакции стал доминирующим промышленным методом.
Степени окисления калия
Электронная конфигурация калия: [Ar]4s 1 . Наиболее распространенная степень окисления K +1 .
Физические свойства калия
Калий — мягкий щелочной металл серебристо-белого цвета. Он может реагировать с водой и кислородом.
- Potassium Symbol: K
- Atomic Number: 19
- Atomic Mass: 39.0983 amu
- Melting point: 312.46 K
- Boiling point: 961 K
- Density: 1.53 g/cm 3
- Electronegativity: 0.8
- Энергия ионизации: 4,341 эВ
- Степень окисления: +1
- Классификация: Щелочной металл, металл I группы
- Естественное содержание 2,6% в земной коре
- Конфигурация электронной оболочки: [Ar]4s 1
- Изотопы. Калий имеет 3 основных изотопа: 39 К, 40 К, 41 К
Где я могу купить калий?
Обычные поставщики химикатов продают калий.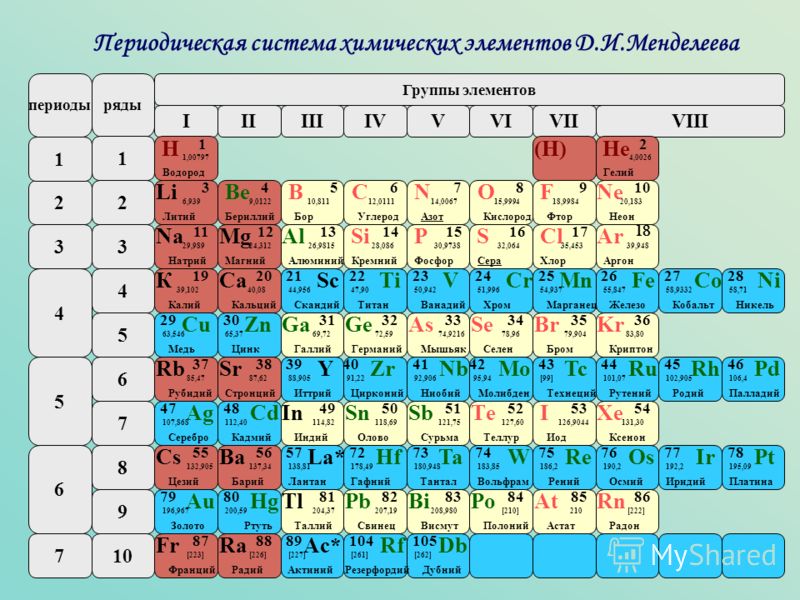 Цена меняется в зависимости от чистоты (обычно 2-5 долларов за грамм). Более низкая чистота металлического калия дешевле. Однако длительное хранение металлического калия является сложным. Сухой нереакционноспособный газ или минеральное масло окружает элемент, чтобы предотвратить образование слоя супероксида калия.
Цена меняется в зависимости от чистоты (обычно 2-5 долларов за грамм). Более низкая чистота металлического калия дешевле. Однако длительное хранение металлического калия является сложным. Сухой нереакционноспособный газ или минеральное масло окружает элемент, чтобы предотвратить образование слоя супероксида калия.
Кроме того, поскольку калий необходим для здоровья человека, в большинстве универсальных магазинов калий продается людям, которые не получают достаточного количества калия в своем ежедневном рационе или испытывают дефицит калия из-за болезни.
Подробнее
- Извлечение металлического калия из бананов
- Щелочные металлы. Периодическая таблица
- Самопроизвольный элемент Цезий
- Соленый элемент Натрий
It’s Elemental 10 Калий 90 Элемент 0 Калий
4
Предыдущий элемент
(аргон)
Периодическая таблица элементов
Следующий элемент
(кальций)
Таблица элементов
Элемент калия
[Click for Isotope Data]
Калий
19Kpotassium39.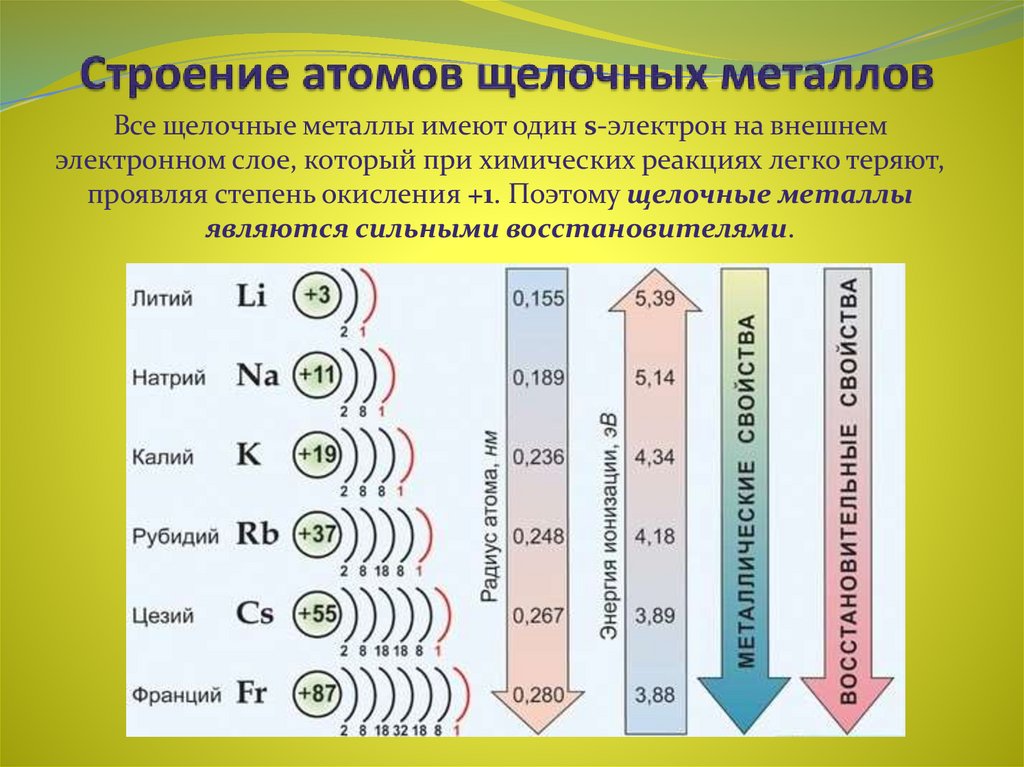 0983
0983
Атомный номер: 19
Атомный вес: 39,0983
Точка смещения: 336,53.38.38 at — °F)
Температура кипения: 1032 K (759°C или 1398°F)
Плотность: 0,89 г на кубический сантиметр
Фаза при комнатной температуре: Твердая
Классификация элемента: Металл
Номер периода: 4
Номер группы: 1
Название группы: Щелочной металл
Что в имени? От английского слова поташ . Химический символ калия происходит от латинского слова, обозначающего щелочь, kalium .
Что сказать? Калий произносится как poh-TASS-ee-em .
История и использование:
Хотя калий является восьмым по распространенности элементом на земле и составляет около 2,1% земной коры, он является очень реакционноспособным элементом и никогда не встречается в природе в свободном виде. Металлический калий был впервые выделен сэром Хамфри Дэви в 1807 году путем электролиза расплавленного едкого кали (КОН). Через несколько месяцев после открытия калия Дэви использовал тот же метод для выделения натрия. Калий можно получить из минералов сильвита (KCl), карналлита (KCl·MgCl 2 ·6H 2 O), langbeinite (K 2 Mg 2 (SO 4 ) 3 ) and polyhalite (K 2 Ca 2 Mg(SO 4 ) 4 ·2H 2 O). Эти минералы часто встречаются на дне древних озер и морей. Едкий калий, еще один важный источник калия, в основном добывается в Германии, Нью-Мексико, Калифорнии и Юте.
Через несколько месяцев после открытия калия Дэви использовал тот же метод для выделения натрия. Калий можно получить из минералов сильвита (KCl), карналлита (KCl·MgCl 2 ·6H 2 O), langbeinite (K 2 Mg 2 (SO 4 ) 3 ) and polyhalite (K 2 Ca 2 Mg(SO 4 ) 4 ·2H 2 O). Эти минералы часто встречаются на дне древних озер и морей. Едкий калий, еще один важный источник калия, в основном добывается в Германии, Нью-Мексико, Калифорнии и Юте.
Чистый калий — это мягкий воскообразный металл, который легко режется ножом. Он реагирует с кислородом с образованием супероксида калия (KO 2 ) и с водой с образованием гидроксида калия (KOH), газообразного водорода и тепла. Производится достаточно тепла, чтобы воспламенить газообразный водород. Чтобы предотвратить его реакцию с кислородом и водой в воздухе, образцы металлического калия обычно хранят погруженными в минеральное масло.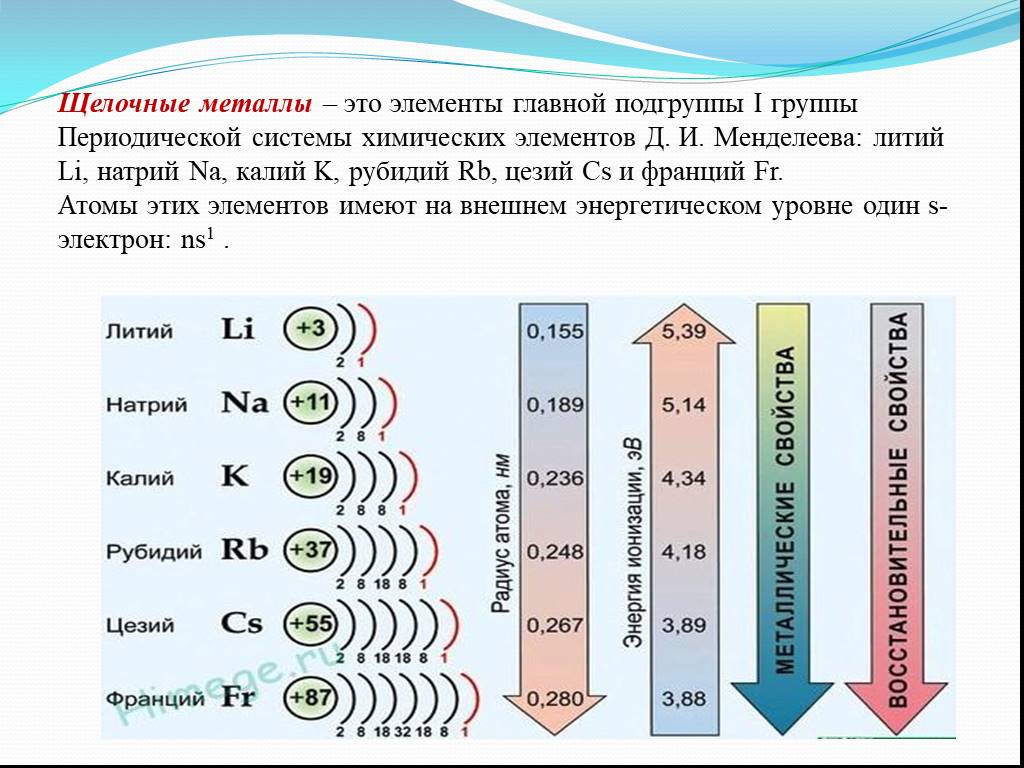
Калий образует сплав с натрием (NaK), который используется в качестве теплоносителя в некоторых типах ядерных реакторов.
Калий образует много важных соединений. Хлорид калия (KCl) является наиболее распространенным соединением калия. Он используется в удобрениях, в качестве заменителя соли и для производства других химических веществ. Гидроксид калия (KOH) используется для производства мыла, моющих средств и средств для чистки канализации. Карбонат калия (KHCO 3 ), также известный как жемчужная зола, используется для изготовления некоторых видов стекла и мыла и в коммерческих целях получается как побочный продукт производства аммиака. Супероксид калия (KO 2 ) может создавать кислород из водяного пара (H 2 O) и двуокиси углерода (CO 2 ) посредством следующей реакции: => 2KHCO 3 + O 2 . Он используется в дыхательном оборудовании и производится путем сжигания металлического калия в сухом воздухе.



 Определение необходимой нормы внесения должно основываться на анализе почвы.
Определение необходимой нормы внесения должно основываться на анализе почвы.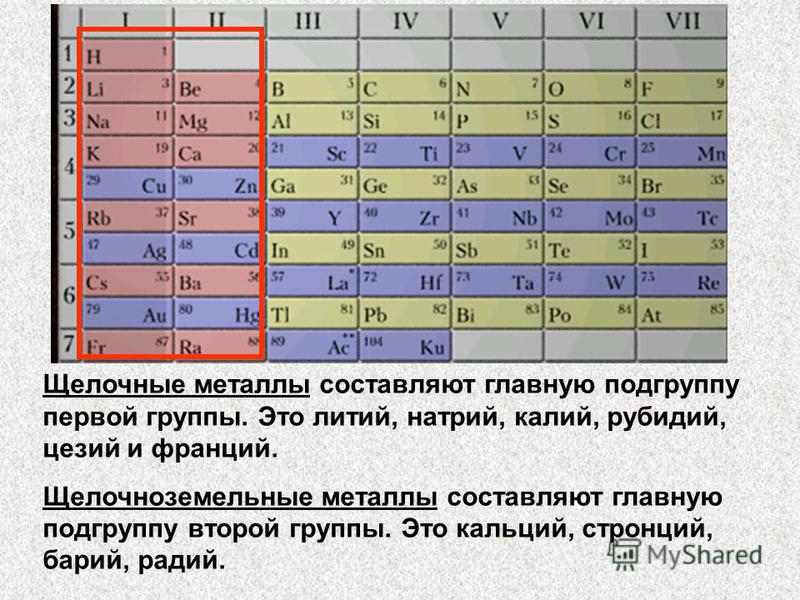
 Пять бананов или одиннадцать бананов обеспечат достаточное суточное количество калия. Однако слишком много бананов также приведет к ужасающим побочным эффектам.
Пять бананов или одиннадцать бананов обеспечат достаточное суточное количество калия. Однако слишком много бананов также приведет к ужасающим побочным эффектам. Бисульфит калия представляет собой химическую смесь с приблизительной химической формулой KHSO 3 . Это не настоящее соединение, а смесь солей, которые дают растворы, состоящие из ионов калия и бисульфита.
Бисульфит калия представляет собой химическую смесь с приблизительной химической формулой KHSO 3 . Это не настоящее соединение, а смесь солей, которые дают растворы, состоящие из ионов калия и бисульфита.