Опухолевый процесс. Общие положения . Классификация. Неопластический процесс что это
Неопластические заболевания.
Необъяснимая лихорадка является частым проявлением многих опухолей. Все твердые опухоли могут вызвать закупорку и последующую инфекцию; следовательно, опухоль и лихорадка могут сосуществовать. В таких ситуациях неопластический процесс не вызывает лихорадку непосредственно. Однако, даже при отсутствии инфекции, определенные опухоли особенно связаны с лихорадкой, когда они лечатся, лихорадка может исчезать. В таких случаях является причиной лихорадки.
Механизм, благодаря которому неопластический процесс вызывает лихорадку, может быть связан с его способностью продуцировать собственные эндогенные пирогены или вызывать продукцию эндогенных пирогенов нормальными лейкоцитами. В дополнение некоторые опухоли, продуцирующие их собственные эндогенные пирогены, а другие под влиянием некроза, в результате быстрее растут и некротические продукты распада вызывают воспаление с лейкоцитарным воспалительным ответом. Эндогенные пирогены могут быть продуктами воспалительных лейкоцитов и могут продуцироваться в связи с некрозом опухоли.
Острая лейкемия может быть связана с лихорадкой и иногда встречается при наличии нормальных мазков периферической крови, как алейкемическая лейкемия и перелейкемия. У таких больных диагноз часто задерживается.
Почечно-клеточная карцинома. Карцинома почки часто коварна, у многих больных нет гематурии, и лихорадка является главным симптомом. Во многих случаях это не метастазы, а скорее хорошо инкапсулированная опухоль. Удаление опухоли почти всегда сопровождается прекращением лихорадки.
Опухоли печени. Имеется большая вероятность метастатической аденокарциномы с метастазами в печень, чем первичной гематомы, но последняя опухоль часто расценивается, как причина лихорадки неясного происхождения. Многим больным с гематомой оказывается медицинская помощь в связи с персистирующей лихорадкой. Первичные метастатические опухоли печени связываются с длительной лихорадкой и не являются диагностической проблемой, когда они сопровождаются желтухой и ненормальными функциональными пробами печени. Однако, больные с нормальными функциональными пробами печени и только лихорадкой поступают в больницу с диагнозом лихорадка неясного происхождения.
Гиперчувствительность и аутоиммунные болезни.
Это значительная группа заболеваний, которая проявляется как лихорадка неясного происхождения, в которые входят в общую категорию гиперчувствительности, аутоиммунных ревматических или коллагеново-сосудистых заболеваний. Больные с этими заболеваниями могут иметь длительную лихорадку, как преобладающий симптом болезни.
Ревматоидный артрит, может быть связан с персистирующей лихорадкой, но у взрослых вовлечение суставов обычно способствует правильному диагнозу. Однако, у детей вовлечение суставов может быть минимальным или отсутствовать и многие больные имеют лихорадку неясного происхождения. Факт, что аутоиммунные заболевания проявляются, как лихорадка неясного происхождения в педиатрических группах, подростковые артриты, является несомненно более частым. Болезнь Стилла диагностируется у тех детей, которые первично имеют системные проявления при отсутствии артрита. Сочетание высокой лихорадки, быстро исчезающей сыпи, лимфоаденопатией и спленомегалией с различной степенью артралгии и миалгии является типичным для болезни Стилла. Ее острое начало может усиливать другие заболевания и может затруднять диагностику.
У взрослых также может быть болезнь Стилла. Начало болезни Стилла у взрослых чаще отмечается в возрасте 20-30 лет. Клинические проявления у взрослых почти идентичны проявлениям у детей. Радиологическое подтверждение нарушения суставов часто отсутствует у взрослых с болезнью Стилла, нет наличия ревматоидного фактора. Характерно повышение количества лейкоцитов с увеличением полиморфонуклеарных лейкоцитов и ускорение скорости оседания эритроцитов. Диагноз болезни Стилла как причина необъяснимой лихорадки у взрослых основанный на наличии сочетания всего симптомокомплекса и при отсутствии других заболеваний.
Острая ревматическая лихорадка больше преобладает у детей, но и у взрослых может проявляться с менее полным сочетанием признаков. Ревматическая лихорадка должна быть дифференцирована от бактериального эндокардита, ревматоидного артрита, системной красной волчанки.
Тироидит обычно связывается с локальной болью и лихорадкой, но не проявляется как лихорадка неясного происхождения. Однако, небольшое количество больных с подострым тироидитом может быть лишен местной болезненности и может иметь персистирующую лихорадку. Обследование щитовидной железы обнаруживает местную болезненность даже при ограниченном вовлечении и соответствующие функциональные тесты щитовидной железы и серологические исследования подтверждают диагноз.
studfiles.net
Паранеопластический синдром - причины, симптомы, диагностика и лечение
Паранеопластический синдром – комплекс клинических и лабораторных признаков онкологического заболевания, не связанных с ростом первичного новообразования и появлением метастазов. Обусловлен неспецифической реакцией организма и выделением опухолью биологически активных соединений. Проявляется эндокринными, дерматологическими, сердечно-сосудистыми, нейромышечными, нефрологическими, гастроэнтерологическими, гематологическими или смешанными расстройствами. Диагностируется на основании анамнеза, симптомов и данных дополнительных исследований. Лечение – удаление либо консервативная терапия первичной опухоли.

Паранеопластический синдром – неметастатические системные клинико-лабораторные проявления онкологического заболевания. Страдают преимущественно больные пожилого и среднего возраста. Паранеопластический синдром чаще возникает при лимфоме, раке легких, раке яичников и раке молочной железы. Иногда становится первым признаком ранее недиагностированного онкологического поражения. Играет как положительную, так и отрицательную роль в процессе диагностики онкологических заболеваний.
При отсутствии клинических проявлений первичного онкологического процесса становится неспецифическим маркером новообразования. Вместе с тем, одновременное появление паранеопластического синдрома и локальных симптомов злокачественной опухоли может усложнять клиническую картину и затруднять распознавание онкологического заболевания. Лечение осуществляют специалисты в области онкологии, эндокринологии, кардиологии, гастроэнтерологии, дерматологии и врачи других специальностей.
Причины паранеопластического синдрома
Основными причинами развития паранеопластического синдрома являются активность злокачественной опухоли и реакции организма на эту активность. Клетки новообразования выделяют биологически активные белки, энзимы, иммуноглобулины, простагландины, цитокины, интерлейкины, факторы роста, активные и неактивные гормоны, влияющие на деятельность различных органов и систем. Контакт нормальных тканей организма с тканью опухоли и выделяемыми ею соединениями провоцирует нормальные иммунные реакции и вызывает развитие аутоиммунных нарушений.
Вероятность возникновения, интенсивность проявлений и характер паранеопластического синдрома зависят от локализации и вида новообразования, способности опухоли выделять различные активные вещества и генетически обусловленной склонности к аутоиммунным нарушениям. Чаще всего паранеопластический синдром развивается при раке легкого. В числе других онкологических заболеваний, часто провоцирующих этот синдром – рак молочной железы, рак яичников, рак почки, лимфомы, лейкозы, гепатоцеллюлярная карцинома, рак желудка, рак поджелудочной железы и опухоли ЦНС.
Характеристика паранеопластических синдромов
Паранеопластические синдромы – обширная группа синдромов, возникающих при злокачественных опухолях. Кроме того, паранеопластические синдромы выявляются при некоторых доброкачественных новообразованиях и заболеваниях неопухолевой природы, в том числе – при ревматических болезнях, хронических неспецифических заболеваниях легких, болезнях сердца, эндокринных заболеваниях и поражении паренхиматозных органов. Возможность вовлечения любых органов и систем, а также разнообразие клинических проявлений паранеопластических синдромов затрудняют создание единой классификации.
Существует несколько вариантов упорядочивания таких синдромов, наиболее распространенным из которых является группировка по органно-системному принципу (с учетом поражения тех или иных органов). Согласно этому варианту, различают эндокринные/метаболические, дерматологические, почечные, нервно-мышечные/неврологические и некоторые другие виды паранеопластических синдромов. Отличительными особенностями всех синдромов являются:
- общие патогенетические механизмы;
- возникновение при онкологических заболеваниях;
- неспецифичность клинической симптоматики и лабораторных показателей;
- возможность развития паранеопластического синдрома до появления локальных признаков опухоли, одновременно с локальными признаками опухоли либо на заключительных стадиях болезни;
- неэффективность терапии, исчезновение синдрома после радикального лечения новообразования и его повторное возникновение во время рецидива.
Развитие паранеопластического синдрома до появления местных признаков опухоли может, как облегчать, так и затруднять диагностику основной патологии. Например, синдром Мари-Бамбергера (оссифицирующий системный периостоз, при котором пальцы приобретают вид барабанных палочек) чаще наблюдается при злокачественных поражениях плевры и легких, но не является их специфическим проявлением, поскольку может обнаруживаться и при других заболеваниях, например, при хроническом обструктивном бронхите, циррозе печени или пороках сердца.
Тем не менее, наличие этого паранеопластического синдрома указывает на высокую вероятность патологии дыхательной системы и позволяет достаточно точно определить перечень необходимых обследований. Другие паранеопластические синдромы, например, лихорадка, тромбофлебит или дерматологические поражения могут трактоваться как самостоятельные заболевания, что ведет к недообследованию, назначению неправильного лечения и запоздалому выявлению онкологических поражений, ставших причиной развития данной патологии. Своевременная диагностика и дифференциальная диагностика этой группы патологических состояний остается актуальной проблемой современной онкологии.
Виды паранеопластических синдромов
Гастроинтестинальные паранеопластические синдромы (потеря аппетита, похудание) – самые распространенные синдромы при онкологических заболеваниях. На определенных этапах злокачественного процесса выявляются практически у всех больных. Основными проявлениями паранеопластического синдрома являются потеря аппетита, изменение вкуса, возникновение отвращения к некоторым пищевым вкусам и запахам. После постановки диагноза, прогрессирования локальной симптоматики и начала химиотерапии гастроинтестинальные расстройства могут усугубляться депрессией, страхом перед тошнотой и рвотой, нарушениями проходимости кишечника и другими обстоятельствами.
Гематогенные паранеопластические синдромы выявляются у большинства онкологических больных. Самой распространенной разновидностью этого паранеопластического синдрома является умеренная или нерезко выраженная нормохромная анемия. В анализе периферической крови нередко обнаруживаются другие признаки основного заболевания: повышение СОЭ, лейкоцитоз и сдвиг лейкоцитарной формулы влево. При В-клеточных лимфоидных новообразованиях паранеопластический синдром может проявляться аутоиммунной гемолитической анемией, при меланоме и лимфоме Ходжкина – гранулоцитозом, при лейкозах – тромбоцитопенией, при раке печени и почек – эритроцитозом.
Эндокринные и метаболические паранеопластические синдромы включают в себя разнообразные гормональные и обменные нарушения. При медуллярном раке щитовидной железы может развиваться гипокальциемия, протекающая бессимптомно или сопровождающаяся повышением нервно-мышечной возбудимости. При мелкоклеточном раке легкого паранеопластический синдром проявляется синдромом Кушинга и водно-электролитными нарушениями. Для феохромоцитом характерно повышение артериального давления, для лимфомы Ходжкина – гипоурикемия, для гематосаркомы и острых лейкозов – гиперурикемия.
Сосудистые паранеопластические синдромы обычно проявляются тромбофлебитами. Могут возникать за несколько месяцев до появления первых признаков онкологического заболевания. Чаще всего выявляются при раке молочной железы, опухолях ЖКТ, раке легких и раке яичников. Половина тробмофлебитов у пациентов в возрасте старше 65 лет связаны с развитием злокачественных новообразований. Сосудистые паранеопластические синдромы плохо поддаются антиагрегантной терапии. После оперативных вмешательств развиваются более чем у половины больных онкологическими заболеваниями. Являются третьей по распространенности причиной летальности в послеоперационном периоде.
Дерматологические паранеопластические синдромы отличаются большим разнообразием. Включают в себя преходящую эритему, приобретенный ихтиоз, паранеопластическую пузырчатку и другие расстройства. Выявляются при лейкозах, медуллярном раке щитовидной железы и некоторых других онкологических заболеваниях.
Неврологические/нервномышечные паранеопластические синдромы сопровождаются поражением центральной и периферической нервной системы. Могут проявляться энцефалитом, деменцией, психозами, синдромом Ламберта-Итона (слабость мышц конечностей, напоминающая миастению, при сохранении тонуса глазных мышц; обычно возникает при опухолях в области грудной клетке, чаще всего при раке легкого), синдромом Гийена-Барре (периферическая нейропатия, выявляется у некоторых больных лимфомой Ходжкина) и другими периферическими нейропатиями.
Ревматологические паранеопластические синдромы встречаются как при ревматоидных заболеваниях, так и при злокачественных новообразованиях. Системный склероз, полимиалгия и ревматоидный артрит характерны для гемобластозов и опухолей толстого кишечника. Паранеопластический синдром в виде вторичного амилоидоза выявляется при почечно-клеточном раке, лимфомах и миеломе. Гипертрофическая остеопатия может наблюдаться при некоторых разновидностях рака легкого.
www.krasotaimedicina.ru
неопластический - это... Что такое неопластический?
прил., кол-во синонимов: 1
Словарь синонимов ASIS. В.Н. Тришин. 2013.
.
- неописуенный
- неопределенно большой
Смотреть что такое "неопластический" в других словарях:
неопластический — неопластический … Орфографический словарь-справочник
неопластический рост — Рост опухолевой ткани [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN neoplastic growth … Справочник технического переводчика
Менингит неопластический — Неопластическая инфильтрация мозговых оболочек может быть карциноматозной, лейкемической и лимфоматозной. Клиническая картина при этом имеет сходство. На первый план выступают интенсивная головная боль, повторная рвота, другие признаки… … Энциклопедический словарь по психологии и педагогике
Тимома — МКБ 10 C37.9, D60 … Википедия
Острые лейкозы — Острые лейкозы группа клональных (онкологических) заболеваний, первично возникающих в костном мозге в результате мутации стволовой клетки крови. Следствием мутации является потеря потомками мутировавшей клетки способности к дифференцировке… … Википедия
Острый лейкоз — Острый лейкоз клональное (онкологическое) заболевание, первично возникающее в костном мозге в результате мутации стволовой клетки крови. Следствием мутации является потеря потомками мутировавшей клетки способности к дифференцировке до… … Википедия
Патологический перелом — Патологический перелом … Википедия
злокачественный — См … Словарь синонимов
Полип (медицина) — Эту статью предлагается разделить на Полип носа, Полип кишечника, Полип матки. Пояснение причин и обсуждение на странице Википедия:К разделению/26 декабря 2012. Возможно, она слишком велика или её содержимое не имеет логической связности, и… … Википедия
ТАМПОНАДА СЕРДЦА — мед. Тампонада сердца скопление жидкости в полости перикарда, вызывающее ограничение наполнения желудочков и предсердий, системный венозный застой и уменьшение сердечного выброса. Этиология • Уремия • Неопластические процессы в грудной полости,… … Справочник по болезням
dic.academic.ru
РАЗДЕЛ 5. НЕОПЛАСТИЧЕСКИЕ ЗАБОЛЕВАНИЯ — КиберПедия
ГЛАВА 78. ОСНОВЫ НЕОПЛАЗИИ
Джон Мендельсон (John Mendelsohn)
Введение. Последние годы отмечены значительным прогрессом в понимании биологических и биохимических основ развития рака. Однако это не означает, что проблема неопластических заболеваний решена. Успехи в лечении рака у взрослых приходили постепенно и касались в основном злокачественных опухолей, характеризующихся необычно высокой чувствительностью к лучевому воздействию и химиотерапии. Они включают прежде всего острый миелоцитарный лейкоз — лимфопролиферативные злокачественные заболевания, рак яичка и молочной железы. Новые способы лечения, включая иммунотерапию и применение веществ, способствующих нормальному созреванию клеток, пока остаются на стадии экспериментов и интенсивного изучения. Между тем начаты поиски соединений, способных взаимодействовать с продуктами онкогенов, генными регуляторами, факторами роста и их рецепторами. Исследования с применением современных методов молекулярной генетики и иммунологии способны обеспечить создание новой группы противораковых веществ, которые в свою очередь могут быть быстро подвергнуты клиническим испытаниям. Такие разработки представляются возможными, поскольку понимание рака как патологического процесса подкрепляется новыми знаниями о нем как о приобретенном генетическом нарушении.
Это глава представляет собой обзор биологии, этиологии и клинических проявлений неопластического процесса, вслед за которым дается описание общепринятых методов диагностики рака, определения его стадии или степени распространенности процесса. Лечение рака описывается в последующей главе, а детали ведения больных определенными формами злокачественных опухолей будут приведены в главах, посвященных поражениям различных органов.
Определение понятия. Термины «рак», «неоплазия» и «злокачественность» широко употребляются как в специальной, так и в популярной литературе. Заболевание, именуемое раком, наиболее полно определяется четырьмя характерными чертами, которые отличают раковые клетки от их нормальных аналогов.
1. Клональность: в большинстве случаев раковая опухоль возникает из единственной стволовой клетки, пролиферирующей с образованием клонов злокачественных клеток.
2. Автономия: рост опухолевых клеток не регулируется должным образом нормальными биохимическими и физическими влияниями со стороны окружающей среды.
3. Анаплазия: отсутствие нормальной координированной клеточной дифференцировки.
4. Метастазирование: раковые клетки приобретают способность к неограниченному росту и диссеминации в другие органы и ткани.
Аналогичные свойства могут проявляться и у нормальных неопухолевых клеток в определенные периоды их жизненного никла, например в ходе эмбриогенеза и репаративной регенерации, но у раковых клеток эти признаки неадекватны или чрезмерно выражены. Процесс, в ходе которого нормальная клетка приобретает указанные черты, называется злокачественной трансформацией.
Таблица 78-1. Оценка количества новых выявленных случаев заболеваний и смертности для рака наиболее часто встречающихся локализаций (1984 г.)
| Место возникновения или тип опухоли | Количество случаев | Количество смертельных исходов |
| Легкое | 139 000 | 121 000 |
| Толстая и прямая кишка | ||
| Молочная железа | ||
| Предстательная железа | ||
| Матка | 55 000' | |
| Мочевые пути | ||
| Полость рта | 27 000 | |
| Поджелудочная железа | ||
| Лейкозы | ||
| Яичники | ||
| Меланома | 180002 |
Включая шейку матки; если суммировать указанное в таблице число случаев с числом рака in situ, то общее число составит 99 000.
2 Оценка количества новых выявленных случаев рака кожи (исключая меланому) около 400 000.
Примечание. Оценка количества наблюдений основана на данных N. С. I. Seer programm 1973—1979 гг.
Клинические аспекты. Одна треть всего населения США находится под угрозой поражения раком. Средняя пятилетняя выживаемость для этих больных (вероятность отсутствия смертельного исхода от рака в течение 5 лет с момента установления диагноза) увеличилась почти до 50% в результате улучшения ранней диагностики и успехов в лечении этого заболевания. Однако рак продолжает занимать второе место среди причин смерти в этой стране, уступая только сердечно-сосудистым заболеваниям. Около 20% американцев умирают от рака, в 1984 г. это составило 450 тысяч случаев. Половина смертельных исходов связана с тремя наиболее часто встречающимися локализациями опухолей: легкое, молочная железа и толстая кишка. Раком легкого чаще болеют мужчины, в то время как рак молочной железы является наиболее частой формой злокачественных опухолей у женщин. Рак толстой кишки встречается одинаково часто у мужчин и женщин. Ежегодно Американское противораковое общество представляет суммарные данные о частоте и уровне смертности при наиболее часто встречающихся типах рака. В табл. 78-1 и на рис. 78-1 представлена лишь небольшая часть доступных сведений об их распространенности. Особого внимания заслуживают данные (см. рис. 78-1) о повышении смертности от рака легкого по сравнению со стабильными или снижающимися цифрами, характеризующими смертность от других злокачественных заболеваний.
Обычно рак представляется врачу как очаг патологического роста тканей или опухоль, которая вызывает недомогание, обусловленное продукцией биохимических активных молекул, местного распространения или инвазии в прилежащие или отдаленные ткани. Симптомы заболевания зависят от характера продуцируемых опухолью молекулярных продуктов и локализации(и) опухолевого процесса. Каждый тип рака характеризуется вполне определенным течением заболевания, лежащим в основе вероятных клинических проявлений конкретного опухолевого процесса. Выбор надлежащего плана лечения для каждого больного злокачественной опухолью зависит от выявленной степени распространенности опухолевого процесса, представлений о его клиническом течении и возможных методах лечения для каждого типа рака.
Биология и биохимия опухолевой клетки. Поскольку все клетки организма происходят из единственной оплодотворенной яйцеклетки, все они несут одинаковую генетическую информацию. Пролиферация и дифференцировка этой клетки в эмбрион, а в конечном итоге — зрелый организм, базируется на избирательной и координированной реализации геномного набора.
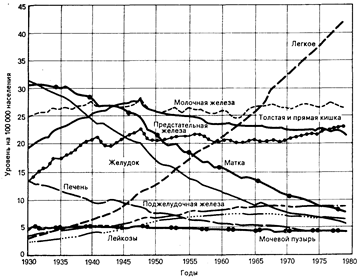
Рис. 78. Уровни смертности от рака различной локализации в США 1930— 1979 гг. (подготовлено Американским противораковым союзом по данным Национального центра статистики здоровья и Бюро переписи).
Контроль за экспрессией генов осуществляется посредством недостаточно известных молекулярных взаимодействий, которые могут быть частично изменены путем химических воздействий со стороны микроокружения. Геномный набор включает информацию, позволяющую клеткам клонально размножаться, функционировать с различной степенью автономии, дифференцироваться и дедифференцироваться, мигрировать от одной части тела к другой. Во взрослом организме процессы раневого повреждения и заживления активируют проявление свойств этих клеток в «эмбриональноподобной» форме, но под хорошо координированным контролем. При злокачественной трансформации нормальный процесс контроля извращается или отсутствует в результате аномального действия особой группы генов (онкогенов), которые имеют ведущее значение в регуляции клеточной активности. Детальное обсуждение онкогенов представлено в гл. 59.
Клональность. Тщательный цитогенетический анализ хромосом раковых клеток в стадии метафазы принес богатую информацию о неопластическом процессе. Стало ясно, что фактически все солидные опухоли и большинство новообразований гематопоэтической системы характеризуются нарушениями кариотипа, наследуемыми популяцией опухолевых клеток. Это может сопровождаться транслокацией фрагментов хромосом в другие участки, добавлением или исчезновением частей хромосом или целых хромосом. У значительной части больных с определенной формой рака нередко возникает серьезное повреждение кариотипа. Первым и наиболее хорошо известным примером такого нарушения является филадельфийская хромосома (РП), выявляемая у 85% больных хроническим миелолейкозом (ХМЛ), при котором длинное плечо хромосомы 22 транслоцировано в длинное плечо хромосомы 9. Это повреждение настолько характерно для ХМЛ, что выявление идентичной транслокации при анализе некоторых случаев острого лимфоцитарного лейкоза было интерпретировано как свидетельство необычной конверсии ХМЛ (как правило, ХМЛ прогрессирует в сторону острого миелоцитарного лейкоза). Характерные перестройки хромосом описаны и при ряде других форм рака у человека.
Выявление однотипных нарушений кариотипа во всех клетках опухоли является важным доказательством клепального происхождения новообразований. В свою очередь хромосомные нарушения служат маркерами злокачественного перерождения конкретных клеток.
Было показано удивительное соответствие между локализацией в хромосоме некоторых клеточных онкогенов и точками разрыва, выявленными при хромосомных транслокациях в злокачественных опухолях у человека. Кроме того, во многих случаях эти локусы коррелировали со «слабыми» точками в хромосоме. Воздействие на культивируемые клетки веществами, подавляющими репарацию ДНК, приводит к частым разрывам хромосом именно в этих точках. Обсуждаемая в настоящее время вполне обоснованная гипотеза связывает эти феномены воедино и предполагает, что перестройки хромосом могут приводить к активации клеточных онкогенов. Например, при лимфоме Беркитта типичная транслокация между хромосомами 8 и 14 ставит клеточный онкоген туе рядом с локусом цепочки тяжелых иммуноглобулинов, местом генной активации нормального лимфоцита.
Исследования избирательной экспрессии Х-связанных изрэнзимов глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) у гетерозиготных больных дали новые свидетельства клонального происхождения большинства типов раковых опухолей из одних и тех же материнских клеток. Исследование изоэнзимов Г-6-ФД и кариотипов у больных ХМЛ выявило клональные нарушения в эритроидных, миелоидных и мегакариоцитарных клетках, как и в В-лимфоцитах, что позволило предположить происхождение данного вида злокачественного поражения из клетки-предшественника, общего для всех этих клеточных линий.
Хотя имеются убедительные доказательства возникновения рака вследствии генетических повреждений одной клетки, кроме того, достаточно часто отмечаются наследственные нарушения, приводящие к образованию комплекса гетерогенных субклонов в популяции зрелых опухолевых клеток. Последняя пролиферирует в достаточной степени для клинического выявления опухоли. Эта гетерогенность может быть показана при анализе всего разнообразия признаков, характеризующих субпопуляции клеток в пределах одной опухоли. Например, дальнейшие нарушения кариотипа, различная чувствительность к воздействию лекарственных препаратов, неодинаковая способность к метастазированию, скорости роста, наличие или отсутствии гормональных рецепторов или особых гликопротеинов клеточной поверхности. Поэтому с течением времени прогрессивное накопление наследственных нарушений в субпопуляциях опухолевых клеток обычно приводит к значительным изменениям фенотипа. Клиническим эквивалентом последних является развитие резистентности по отношению к ранее эффективным лечебным воздействиям или дальнейшее прогрессирование метастатического процесса. Появление новых хромосомных нарушений у больных ХМЛ с наличием хромосомы Рп" означает начало быстрого прогрессирования опухолевого процесса фатальной фазы заболевания. Схематическая модель процесса клональной прогрессии представлена на рис. 78-2. Остается определить, когда в ходе развития типичного злокачественного новообразования наступает процесс клональной прогрессии: ряд генетических повреждений может возникать на ранних этапах с более поздним распространением отдельных субпопуляций из гетерогенной смеси клеток по мере изменения условий; и, наоборот, могут иметь место генетические нарушения с очень коротким временным интервалом между их возникновением и выявлением на основе изменений в поведении опухолевых клеток. Вслед за открытием клеточных онкогенов быстро накопились свидетельства, позволяющие полагать, что последовательная активация двух или более таких генов может составлять основу молекулярно-генетической теории клональной прогрессии субпопуляции опухолевых клеток. Кроме транслокации, активация клеточных онкогенов может быть результатом действия ряда других генетических механизмов. Эти механизмы включают амплификацию генов или прикрепление активатора транскрипции, прилежащих к цнс или находящихся в транссвязи с клеточным онкогеном в присутствии или в отсутствие сопутствующих мутаций специфических нуклеотидов в цепочке ДНК онкогенов. Многие из этих изменений не выявляются в кариотипе, но их можно идентифицировать посредством специального анализа расщепленной клеточной ДНК или разложения ДНС.
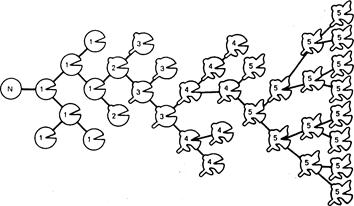
Рис. 78-2. Схематическая модель клональной прогрессии. N-клетка является нормальной. Отмечены пять гипотетических генетических изменений:
1 — не приводит к малигнизации; 2 — вызывает малигнизацию, 3 — прибавляет свойство инвазивности; 4 — обусловливает способность к диссеминации и образованию метастазов и 5 — вызывает резистентность к химиотерапии. Каждое из этих изменений может сопровождаться инкреминированными нарушениями кариотипа с возрастающей склонностью к анеуплоидии в процессе последующей клональной эволюции.
Автономия. Влияние факторов среды, регулирующих пролиферацию нормальных клеток, при возникновении злокачественной трансформации извращается. Это демонстрируется рядом экспериментальных воздействий, которые так или иначе свидетельствуют о сохранении злокачественными клетками способности к пролиферации в условиях, рассматриваемых обычно как неблагоприятные (табл. 78-2).
По крайней мере на начальных этапах опухолевого роста автономия злокачественных новообразований у человека представляется скорее относительной, чем абсолютной. Хорошо известные эксперименты Huggins с сотр. в 50-х годах привели к возникновению нового подхода к лечению рака, который предусматривал изначальную зависимость некоторых опухолей от обычных воздействий половых гормонов. Конверсия многих форм рака предстательной и молочной желез от чувствительности к резистентности в ходе гормональной терапии наглядно демонстрирует дальнейшее развитие автономии посредством клональной прогрессии.
Таблица 78-2. Экспериментальное обнаружение злокачественной трансформации
| Характер оценки | Нормальная клетка | Трансформированная клетка |
| Способность отдельных клеток к формированию колоний в агаровой суспензии | Ограниченная | Имеется |
| Выраженная зависимость замедления клеточной пролиферации в жидкой | Имеется | Отсутствует |
| культуре от плотности культуры | ||
| Генерации клеток, возникающие в результате непрерывного деления в жидкой культуре | Не более 50 | Неограниченны |
| Потребность в сыворотке крови или факторах роста | Постоянная | Уменьшена или отсутствует |
| Способность к независимому росту | Отсутствует | Имеется |
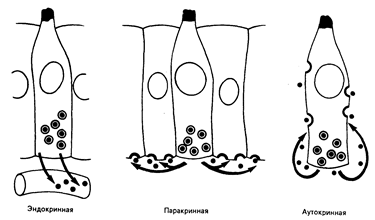
Рис. 78-3. Схематическое изображение аутокринной, паракринной и эндокринной секреции.
Пептидные факторы роста показаны в латентной форме внутри клетки. Утолщенные полукруглые участки клеточной мембраны представляют собой рецепторные зоны (из М. В. Sporn, G. J. Tobaro — New Engl. J. Med., 1980, 303, 878).
Многие линии опухолевых клеток могут пролиферировать в культуральной среде без обычных компонентов сыворотки крови при условии, что к'ней добавляется «коктейль», содержащий от трех до пяти факторов роста и другие стимулирующие рост клеток вещества. Примерами таких факторов являются эпидермальный фактор роста, тромбоцитарный фактор роста, белковый носитель трансферрина и инсулин. Однако для развития злокачественных клеток присутствие этих весьма существенных факторов не обязательно. В экспериментальных условиях был обнаружен механизм, возможно имеющий и клиническое значение, базирующийся на продукции фактора роста (или его аналога) самими опухолевыми клетками. Этот процесс получил название аутокринной секреции. В этом случае гликопротеин, секретируемый опухолевыми клетками, оказывается способным связываться с рецепторами на поверхности опухолевых клеток, что приводит к аутостимуляции (рис. 78-3). Первый аутокринный фактор опухолевого роста, на котором следовало бы остановиться, это трансформирующий а-фактор роста, аналог эпидермального фактора роста. В других случаях опухолевая клетка может активировать внутренний биохимический процесс, обычно зависящий от связывания специфического фактора роста с рецептором клеточной поверхности, тем самым полностью снимая необходимость присутствия стимулирующего рост агента.
Анаплазия. Отсутствие нормальной дифференцировки опухолевых клеток служит критерием, наиболее часто применяемым в диагностике злокачественности опухолевого процесса. Раковым клеткам присущи некоторые морфологические признаки нормальных зрелых аналогов. В то же время при исследовании опухолей с помощью светового микроскопа легко обнаружить отклонения структуры как на уровне отдельных клеток, так и их скоплений. Для них характерны крупные ядра с более структурированным хроматином и четко сформированными ядрышками. Здесь определяются увеличенное количество митозов, в том числе и патологических, и гигантские опухолевые клетки, содержащие несколько ядер, что свидетельствует об анеуплоидии и/или нарушениях кариокинеза. Выраженность морфологических изменений обычно коррелирует со степенью распространенности опухолевого процесса или метастатическим потенциалом опухоли. Гистологическая картина злокачественности характеризуется картиной беспорядка с частичной или полной утратой нормальной архитектоники субстрата. Однако можно полагать, что даже в малодифференцированных злокачественных новообразованиях возможно формирование структур, напоминающих железы или ворсинки.
На биохимическом уровне анаплазия сопровождается продукцией гормонов или связанных с гормонами пептидов, которая либо извращенно регулируется нормальными механизмами обратной связи (например, избыточная продукция кортикостероидов опухолевыми клетками рака коры надпочечников), либо несвойственна этому типу клеток при условии их нормальной дифференцировки (например, продукция АКТГ клетками рака легкого). В подобных случаях геномный набор опухолевых клеток- реализуется несвойственным образом. Другим примером является нерегулируемое образование иммуноглобулина (частичная или полная цепочки) неонластическими дериватами В-лимфоцитов.
Гистологические признаки аномального характера, не согласующиеся с критериями анаплазни (утрата дифференцировки), описываются под названием диспластических. Подобные изменения могут обнаруживаться при пред-раковых состояниях, например, в эпителиальной выстилке бронхов курильщиков сигарет. Эти нарушения часто обратимы. Прекращение курения может привести к нормализации легочного эпителия через 5 лет.
Метастазироваиие. Этот термин объединяет ряд фенотипических признаков, совокупность которых и составляет осложнение, наиболее часто ведущее к смерти больного при раке. Клетки утрачивают способность к сцеплению и точное положение в организованной ткани, мигрируют к близлежащим участкам, приобретают способность к проникновению в кровеносные сосуды и выходу из них, к пролиферации в несвойственном для них месте и среде обитания. Эти изменения сопровождаются биохимическими нарушениями, способствующими метастатическому процессу. Инвазивные опухоли могут секретировать ряд энзимов, разрушающих ткани, включая коллагенааы и лизосомные гидролазы. Кроме того, продуцируются активаторы плазминогена, способствующие фибронолизу. В противоположность этому на тех стадиях, когда образование очага опухолевых клеток может иметь значение для их выживания, в окружающую среду могут высвобождаться прокоагулянтные соединения. В экспериментальных условиях, когда опухолевые клетки проявляют склонность к избирательному поражению некоторого органа как предпочтительного очага метастазирования, представляется, что молекулы поверхности метастатических клеток обнаруживают высокую степень сродства к эндотелиальным клеткам сосудистого русла органа-мишени. В процесс развития опухоли от гомогенного пролиферирующего клона до группы гетерогенной субпопуляции клеток вовлечен целый ряд биохимических превращений. Некоторые из этих популяций прогрессивно накапливают целый спектр энзимов и молекул поверхности, необходимых для реализации процесса метастазирования. Возможно именно по этой причине на ранних этапах опухолевого роста частота метастазирования низка, несмотря на высвобождение из опухоли в общую циркуляцию злокачественных клеток в большом количестве и на протяжении длительного периода. Вещества, способные блокировать критические моменты в процессе метастазирования, имели бы огромное значение в арсенале противоопухолевых средств, доступных для врача.
Представляется, что клональная прогрессия опухоли вызывает такие биохимические или функциональные сдвиги, которые приводят к большей автономии, более высоким степеням анаплазии и большей способности к метастазированию. Вследствие прогрессивного характера селекции клеток с повышенной способностью к образованию опухоли, процесс получил название клональной эволюции. По своему значению этот процесс вполне сопоставим с дарвинской теорией эволюции, но в данном случае все указанные изменения происходят на клеточном уровне.
Этиология, Частота рака варьирует в зависимости от пола, расовой принадлежности и географического местонахождения индивида. Кроме того, типы наблюдаемых опухолей различаются в зависимости от возраста. Некоторые особенности частоты неопластических заболеваний объясняются наследственными чертами и изменениями внутренней среды и микроокружения клеток. Эпидемиологические исследования показывают, что характер питания и воздействие химических и физических факторов окружающей среды также вносят свой вклад в процесс развития опухоли. Факторы среды, оказывающие влияние на частоту рака, распределяются в виде трех больших групп: радиация, химические вещества, вирусы.
cyberpedia.su
Опухолевый процесс. Общие положения . Классификация
На данный момент установлено, что в основе опухолевого роста лежат 2 фактора :
клеточный и внеклеточный.
Клеточный - это фактор контактного торможения, действие которого можно наблюдать на агаровых культурах, когда растущие навстречу друг другу клеточные массы при соприкосновении прекращают размножаться и формируют по всей поверхности только один слой клеток.
Внеклеточный – это биохимическое вещество, которое вырабатывается клетками и по мере накопления его срабатывает стоп-сигнал, блокирующий пролиферацию клеток. Это вещество называют кейлоном
Кейлоны это гликопротеиды с молекулярным весом 30-40 тысяч. Они блокируют митотическую активность клетки в определенной фазе. Они обладают органоспецифическим свойством - действует на клетки одного и того же органа. Есть кейлоны печени, почек и т.д. Много исследований проводится в рамках канцерогенеза \ опухолевого роста \ и роли клеточных органелл.
Особое значение придается изменениям состояния ядра клетки - состоянию генома и ядерным белкам \гистонам \. Установлено, что изменения генома раковой клетки весьма тонкие. Причем раковая клетка способна воспроизводить целый организм\ опыты на раковых опухолях почек леопардовых лягушек\. Но эти небольшие структурные изменения в геноме делают главное : они делают раковую клетку похожей на одноклеточное существо. А это одноклеточное существо теряет способность реагировать на контролирующие импульсы. Оно свободно передвигается по всему организму и в любом месте начинает размножаться, разрушая нормальные клетки и ткани. Что и ведет к гибели всего организма.
Статистика заболеваемости опухолями.
Смертность от опухолей составляет около 20% от общей смертности. Средний возраст умерших 50 - 60 лет. Причем заболеваемость возрастает, особенно такими опухолями как рак легких, молочной железы .
ЭПИДЕМИОЛОГИЯ
Считается, что главным фактором опухолевого роста является экзогенный фактор. Об этом свидетельствуют и изучение географической распространенности опухолей.
Большую роль в развитии опухолей играют вредные привычки.
Профессиональный рак.
Профессиональный рак составляет 5% всех раковых болезней.
Примеры профессионального рака-
- рак мошонки трубочистов \ впервые описан в Англии в 19 веке у мужчин в 40-45 лет, которые в детстве чистили трубы каминов, и у которых в коже мошонки накопилось много каменноугольной пыли\;
- асбестоз – рак легких у работников асбестовой промышленности;
- анилин и рак мочевого пузыря у рабочих химической промышленности
- рентгеновские облучения и рак кожи рук у первых рентгенологов.
Все это свидетельствует о большом значении в развитии опухолей факторов внешней среды. Генетические исследования показали, что наследственная предрасположенность к опухолям составляет только 0,1 %. Поэтому борьба с онкологической заболеваемостью должна сводиться к уменьшению промышленных выбросов канцерогенов в воздух, запрещению ядерных испытаний, улучшению качества жизни и исключению вредных привычек.
ЭТИОЛОГИЯ ОПУХОЛЕЙ
Теории опухолевого роста. Их много , но особое значение имеют 4 теории.
.
1\ Физико-химическая теория.
Автор теории немецкий ученый Рудольф Вирхов- 1855 год.
Согласно этой теории опухоли вызываются длительным повреждающим действием физических и химических факторов. Примеры – рак в рубце после ожога, многочисленные профессиональные раки, паразитарные инфекции, гормональные раки, раки при курении, действии радиоактивных веществ, стронция, кобальта и других факторов. Теория достаточно основательно подтверждает идею полиэтиологичности рака. Но не отвечает на вопрос - о механизмах перерождения нормальной клетки в раковую.
2\ Вирусная и вирусно-генетическая теория.
Автор – советский ученый Лев Зильбер – вторая половина 20 века.
По этой теории главным фактором, который вызывает превращение нормальной клетки в раковую клетку является онкогенный вирус, который встраивается в геном клетки. А все остальные физические и химические факторы действуют только как активаторы вируса.
Выделяется две фазы канцерогенеза-
1\ поражение генома вирусом \ фаза инициации\
2\ активизация и превращение нормальной клетки в раковую.
На опухолевый рост оказывают влияние и другие факторы.
3\ Дизонтогенетическая теория.
Автор - немецкий ученый Конгейм, 19 век.
По данной теории считается, что источником опухоли являются пороки развития тканей с наличием эмбриональных клеток. Именно эмбриональные клетки затем превращаются в раковые клетки. Эта теория имеет ограниченное значение. Так как только небольшая группа опухолей имеет чисто эмбриональное происхождение. Примером такой опухоли может быть дермоидная киста яичника. Опухоль представляет собой полость. Стенкой полости является кожа\дерма\. Внутренняя поверхность полости покрыта эпидермисом и содержит придатки кожи – сальные, потовые железы и волосяные фолликулы. Снаружи располагается подкожно-жировая клетчатка. В полости дермоидной кисты накапливаются жировые массы, пучки волос, а в стенке могут находиться зачатки зубов.
4\ Полиэтиологическая теория.
По этой теории представляется, что опухоль могут вызывать все факторы - химические, физические, вирусы, бактерии, то есть очень много факторов. Опухоль – это процесс полиэтиологический. И это вполне справедливо. Но теория не отвечает на механизмы трансформации нормальной клетки в раковую. Это ее слабость.
В настоящее время большинство исследователей приходят к выводу, что опухолевый процесс имеет много причин. Но механизм опухолевого роста заложен в состоянии генома клетки. Главное- изменение функции генома с появлением особого свойства клетки - непрерывному, бесконтрольному размножению. Причем эти свойства передаются затем от одной популяции раковых клеток к другой. Вероятно, изменения генома очень тонкие, поскольку ядро раковой клетки при пересадке в энуклеированную яйцеклетку после оплодотворения дает нормальный организм \ опыты Маккиннэма с раковыми клетками леопардовой лягушки\.
МОРФОГЕНЕЗ И ГИСТОГЕНЕЗ ОПУХОЛЕЙ
1\ Понятие об опухолевой прогрессии
Опухолевый процесс является процессом стадийным, постепенным. Он протекает в несколько этапов и характеризуется постоянностью и однонаправленностью. Это значит - процесс имеет начало , но не имеет конца. На первом этапе опухолевого процесса образуется доброкачественная опухоль. На втором этапе происходит превращение доброкачественной опухоли в злокачественную.
Выделяют 2 группы доброкачественных опухолей:
- опухоли с минимальным риском малигнизации
- опухоли с высоким риском малигнизации
В практической онкологии теория опухолевой прогрессии находит свое подтверждение в том, что опухоли часто предшествуют хронические язвенные процессы, рубцы, дисрегенерация, хроническое воспаление, то есть предраковые процессы.
2\ Предрак. Сущность. Морфология.
Развитию рака предшествуют в местах раздражения появление опухолевого зачатка. Клетки опухолевого зачатка в последующем в результате мутации формируют клон опухолевых клеток.
Клон опухолевых клеток теряет нормальные морфологические, биохимические, физиологические свойства. Опухолевая клетка становится бесконтрольной, и главное приобретает способность к безудержному размножению.
На предварительном этапе большое значение имеет дисплазия клеток, особенно эпителия. Выделяют 3 стадии дисплазии: 1\слабая дисплазия
2\умеренная дисплазия
3\ тяжелая дисплазия.
Тяжелая дисплазия является предраковым процессом.
Предраковые процессы весьма разнообразны.
К ним относятся по органам:
шейка матки- лейкоплакия, эрозии;
тело матки- полипы, железистая гиперплазия
молочная железа и простата - узловатые и диффузные гиперплазии
кожа – язвы, трещины, кератоз, лейкоплакии, дерматозы
желудок - хронические язвы, хронический гастрит, полипы
кишечник - полипоз
печень - цирроз
легкие - хроническая пневмония, метаплазия эпителия при хронических бронхитах;
центральная нервная система - субэпендимальные бляшки, глиозы, реактивные разрастания арахноидального эндотелия.
Сроки перехода предрака в рак очень различны.
Поэтомы выделяют 2 типа предраков: облигатный и факультативный.
К облигатному предраку относятся - полипы толстого кишечника, желудка, аденомы печени, фиброзно-кистозная мастопатия с пролиферацией эпителия.
К факультативным предракам можно отнести такие процессы как гиперплазии, дисплазии.
Исключительную роль в переходе предрака в рак играет строма.
Исследования выдающегося советского патанатома В.Г. Гаршина \ Ленинград\ показали:
1\ эпителий никогда не врастает в зрелую соединительную ткань;
2\рак возникает при разобщении системы: эпителий-строма;
3\ изменения в соединительной ткани предшествуют раку.
ЗНАЧЕНИЕ БИОПСИИ В ДИГНОСТИКЕ ОПУХОЛЕЙ
Диагностика предраковых состояний, ранних форм рака - основная задача медицины. В решении её особую роль играет патологоанатом. Для этого им производится прижизненное патоморфологическое исследование \ биопсия\ кусков тканей у больных в ходе диагностического процесса и при хирургических вмешательствах.
Методы биопсии.
Морфологический - макро-микроскопический.
Цито-биопсия - морфологическое исследование материала в ходе операции.
Гистохимия- выявление различных химических включений .
Гистоферментохимия - выявление ферментов в изучаемых тканях.
Электронная микроскопия- анализ состояния органелл, клеток и межклеточного вещества при больших увеличениях.
Культура тканей - выращивание изучаемых тканей на питательных средах и подбор наиболее действенных химиопрепаратов.
Цитология - изучение опухолевых клеток по мазкам – отпечаткам.
Применяются также методы с использованием изотопов, люминесценции, иммуноморфологии.
ВНЕШНИЙ ВИД И СТРОЕНИЕ ОПУХОЛЕЙ.
Опухоли отличаются исключительным анатомическим и гистологическим разнообразием.
Форма опухолей может быть в виде узла, грибовидной, в виде цветной капусты, уплощенной, блюдцевидной, узловато-разветвленной, кольцевидной.
Поверхность – гладкая, бугристая, шероховатая, сосочковая.
Расположение – диффузное, в виде полипа, образование на ножке, поверхностное, глубокое.
Отношение к соседним тканям—сдавление, разъедание стромы, паренхимы, сосудов.
Вид на разрезе - гомогенный, слоисто-белесоватый \рыбье мясо\, с наличием очагов некрозов, кист, отложений извести, кровоизлияний.
Размеры - колеблются в широчайших пределах, в литературе описан случай кистомы яичника массой 49 кг. Большим весом могут отличаться лейомиомы матки, нередко вес этих опухолей достигает 3-4 кг.
Консистенция зависит от происхождения опухолей . Она может быть мягкой, плотной, в виде костной или хрящевой тканей.
Для опухоли характерны вторичные изменения, соответствующие обычным общепатологическим процессам. Это – некрозы, кровоизлияния, воспаление и т. д..
Микроскопическая картина опухолей отличается большим разнообразием. Основными структурами опухолей являются паренхима и строма. Но в отличие от нормальных тканей соотношение между этими структурами всегда атипичны.
В зависимости от степени атипизма выделяют опухоли:
1\ Гистиоидные опухоли характеризуются преобладанием паренхимы над стромой. Это обычно злокачественные опухоли.
2\ Гомотипические опухоли напоминают исходную ткань.
Это доброкачественные опухоли.
3\ Гетеротипичные опухоли существенно отличаются от исходной ткани, что является признаком злокачественности.
4\Гетеротопические опухоли имеют совершенно иной вид, чем исходная ткань. Это объясняется тем, что источником опухоли является гетеротопический зачаток, который сместился в необычное место в процессе дисэмбриогенеза\ пример: ткань поджелудочной железы в стенке желудка\.
Для опухоли всегда характерен тканевой и клеточный атипизм, то есть морфологическое отличие от нормальной ткани.
Тканевой атипизм проявляется в неравномерном распределении стромы, деформации клеточных структур, разнообразии строения сосудов.
Клеточный атипизм проявляется в изменении формы ядра, гиперхромности ядра, монотонности строения, утрате органотипических, гистотипических, цитологических особенностей.
Ультраструктурный атипизм выражется в увеличении рибосом, расширении эндоплазматической сети , изменении размеров и формы митохондрий, увеличении лизосом, увеличении мембранных контактов с ядором, изменнии метоболизма по типу эмбриональной клетки.
Для опухоли характерно усиление митотической активности и появление больших количеств патологических митозов.
Для опухоли характерна также биохимическая и гистохимическая атипия. Вопрос об обратимости опухолей в настоящее время пока решается отрицательно.
Функциональные возможности опухолевых клеток частично сохраняются. Особенно это свойственно опухолям из эндокринных органов. Опухоли этой группы способны продуцировать различные гормоны\ половые гормоны, инсулин, кортикостероиды и т.д.\, что предопределяет исключительно интересные и даже экзотические клинио-морфологические картины патологии.
Рост опухолей.
Различают 3 типа роста опухолей:
- Экспансивный - рост опухоли в виде узла за счет размножения собственных клеток.
- Аппозиционный – рост опухоли за счет присоединения к опухолевому узлу соседних клеток.
- Инфильтрирующий - рост опухолевых клеток вглубь подлежащей ткани.
В полостных органах различают также эндофитный и экзофитный типы роста опухоли.
Эндофитный рост- это рост опухоли вглубь тканей. Экзофитный рост – это рост опухоли в полость органа в виде полипозного узла.
ТИПЫ ПОВЕДЕНИЯ ОПУХОЛЕЙ
По типу поведения опухолей различают –
1\ доброкачественные опухоли
2\злокачественные опухоли
3\опухоли с местным деструирующим ростом.
1\ Доброкачественные опухоли.
Признаки:
- рост медленный, экспансивный
- размеры – могут быть очень большими в зависимости от локализации
- микроскопическая картина очень похожа на исходную ткань
- клиника зависит от локализации и в областях, когда не затрагиваются жизненно важные органы, например в брюшной полости опухоли достигают очень больших размеров без существенных клинических проявлений.
2\ Злокачественные опухоли.
Рост – быстрый инвазивный с активным разрушением нормальных тканей.
Рецидив – опухоль часто дает повторный рост после удаления.
Влияние на организм – местное за счет разрушения тканей, и общее как результат тяжелой интоксикации с развитием дистрофических процессов в организме.
И исключительно важное свойство злокачественных опухолей – это МЕТАСТАЗИРОВАНИЕ. Перенос опухолевых клеток в различные места с развитием там новых опухолевых узлов. Метастазирование процесс очень сложный. В его развитии определяется 6 этапов :
1\ подрастание 2\ инвазия 3\ эмболия 4\ фиксация 5\выход в ткани
6 \ формирование метастатического очага на новом месте.
Пути метастазирования :
1\ лимфогенный – по лимфатическим сосудам;
2\гематогенный – по кровеносным сосудам ;
3\ периневральный – по футлярам нервов;
4\ имплантационный - рассеивание опухолевых клеток.
3\ Опухоль с местнодеструирующим ростом занимает промежуточное положение между доброкачественной и злокачественной опухолью. Она может инфильтративно врастать в ткани, но она не дает метастазов.
ОПУХОЛИ И ИММУННЫЙ ПРОЦЕСС.
Выделяют два вида противоопухолевого иммунитета – гуморальный и клеточный. Гуморальный иммунитет- это ответ иммунной системы на опухолевый антиген с помощью соответствующих антител. Клеточный иммунитет – это иммунный ответ с активизацией Т лимфоцитов и макрофагов. К сожалению, при злокачественных опухолях оба типа иммунитета не срабатывают. НО в перспективе возможны эффективные способы воздействия на опухоль через иммунную систему.
Особые названия:
Рак - злокачественная опухоль из эпителия
Саркома - злокачественная опухоль из мезенхимальных тканей
\ например, фиброзная ткань – фибросаркома\.
КЛАССИФИКАЦИЯ ОПУХОЛЕЙ
Принцип – гистогенетический.
Выделяют 7 групп опухолей.
1\ Эпителиальные – из неспецифического эпителия.
2\ Эпителиальные – из специфического эпителия.
3\ Мезенхимальные
4\ Из меланинообразующих тканей
5\ Из нервных тканей
6 \ Из кроветворных клеток
7\ Тератомы.
dendrit.ru
Способ оценки риска развития неопластического процесса в предстательной железе у мужчин старше сорока лет
Изобретение относится к медицине, а именно к урологии, и предназначено для оценки риска развития неопластического процесса в предстательной железе у мужчин старше сорока лет. Проводят трансректальное допплеровское исследование венозного простатического сплетения с применением эндокавитального датчика 7-9 МГц. При наличии на спектрограмме монофазного псевдопульсирующего кровотока, не синхронизированного с актом дыхания, делают вывод о наличии атипичного типа кровотока и оценивают риск развития неопластического процесса в предстательной железе как средний. При наличии на спектрограмме монофазного псевдопульсирующего кровотока с преобладанием пульсовых волн, синхронизированных с актом дыхания, делают вывод о наличии переходного типа кровотока и оценивают риск развития неопластического процесса в предстательной железе как низкий. При наличии на спектрограмме монофазного, сглаженного по форме огибающей доплеровского спектра кровотока делают вывод о наличии выраженно-атипичного типа кровотока, риск - высокий. Способ позволяет осуществить с высокой точностью оценку риска развития неопластического процесса в предстательной железе у мужчин старше сорока лет. 1 табл., 3 ил.
Изобретение относится к области медицины, а именно к урологии. Рак предстательной железы (РПЖ) является одной из актуальных проблем современной онкологии. На Первой международной консультации по раку простаты в 1996 г. было подчеркнуто, что по-прежнему отмечается тенденция к росту заболеваемости РПЖ и смертности мужчин пожилого возраста во многих странах мира. В последнее десятилетие наметилась тенденция к распространению заболевания у больных сравнительно молодого и работоспособного возраста.
Рак простаты занимает первое место в структуре онкологической заболеваемости и второе место (после рака легких) в структуре онкологической смертности у мужчин в промышленно-развитых странах.
Из используемых в современной практике инструментальных методов диагностики рака предстательной железы в качестве примера можно привести компьютерную томографию, магниторезонансную томографию (МРТ). Однако одним из существенных недостатков данных методов является лучевая нагрузка на пациентов, что соответственно ограничивает их применение, особенно в качестве скрининга (Аляев Ю.Г., Винаров А.З., Синицин В.Е. Место МРТ при обследовании больных РПЖ. М., 2002, с.4-6).
Наибольшее распространение получил метод трансректальной ультразвуковой эхографии (ТРУЗИ), особенно с применением таких технологий, как тканевая гармоника, режимы цветового (ЦДК) и энергетического картирования (ЭД) (Мазо Е.Б. и др. Трехмерная эхография в диагностике и прогнозировании лечения рака предстательной железы. Вестник РОНЦ им. Н.Н.Блохина РАМН, т.19, №1, 2008, с.7-14). При помощи ТРУЗИ исследователь получает качественное двухмерное либо трехмерное (в зависимости от технических возможностей) изображение, позволяющее оценить детальные изменения структуры предстательной железы (ПЖ), а с применением режимов ЦДК и ЭД характер изменений интраорганного кровотока. Однако, как указывают сами исследователи, характер изменений в режиме серой шкалы при различных патологических состояниях ПЖ, а особенно при РПЖ не имеет характерных патогномоничных признаков. Изучение изменения показателей кровотока в различных образованиях и участках с измененной структурой ПЖ имеет свои затруднения за счет хаотичности развития патологического сосудистого русла, а по данным литературы лишь 50% РПЖ имеет аномальное кровоснабжение. Кроме того, в некоторых случаях для исследования интраорганного кровотока необходимо применение специального эхоконтраста, что значительно усложняет процесс исследования и в качестве скрининга делает его невозможным. Кроме того, известный метод не является визуализирующей методикой, сама реовазография - это косвенная оценка показателей степени кровоснабжения и в настоящее время не используется. Необходимость введения одного электрода в уретру относит данный метод к инвазивным, а соответственно не исключает возможных осложнений. Как метод ранней диагностики РПЖ вообще не приемлем, т.к. оценивает изменения кровоснабжения «всей» доли (правой или левой) ПЖ.
Наиболее близким аналогом является способ оценки риска развития неопластического процесса в предстательной железе путем определения факторов риска - возраст, диета, наследственность (Хансон К.П., Имянитов Е.Н. Эпидемиология и биология рака предстательной железы. Практическая онкология. №2(6) (июнь) 2001, с.3-7).
Достигаемым (при осуществлении настоящего изобретения) техническим результатом являются
- возможность осуществления с высокой точностью оценки риска развития неопластического процесса в предстательной железе у мужчин старше сорока лет. При использовании разработанного метода за последние 10 лет не было случая «запущенных раков», т.е. неопластический процесс выявлялся в пределах ПЖ.
- используемый датчик позволяет получать качественное изображение в серошкальном режиме, а также проводить исследования венозного простатического сплетения в режиме цветового и энергетического картирования для оценки факта наличия спонтанного кровотока в этих венах (как наиболее информативного показателя, с т.з. выявления неопластических процессов), их проходимости, а также проводить исследования в режиме импульсного доплера для спектральной оценки венозного оттока.
Изменения спектра венозного кровотока в простатическом сплетении при неопластическом процессе в предстательной железе можно объяснить следующим образом. Предстательная железа, как сторомальный орган не имеет капиллярного резерва, имеет три пути венозного оттока. Неопластический процесс приводит к аутоимунной реакции с развитием локальных или диффузных инфильтративных изменений в тканях (в зависимости от выраженности неопластического процесса), что приводит к "сдавливанию" капилляров и, как следствие, раскрытию патологических артериоло-венулярных шунтов, что позволяет, в свою очередь, "передавать энергию систолы" на волну венозного спектра, делая его прерывистым (формируя псевдопульсирующий кровоток).
Способ осуществляется следующим образом. У мужчины старше сорока лет проводят трансректальное доплеровское исследование венозного простатического сплетения с применением эндокавитального датчика 7-9 МГц. Оценивают изменения спектральных характеристик кровотока. При наличии на спектрограмме монофазного псевдопульсирующего кровотока, не синхронизированного с актом дыхания, делают вывод о наличии атипичного типа кровотока и оценивают риск развития неопластического процесса в предстательной железе как средний. При наличии на спектрограмме монофазного псевдопульсирующего кровотока с преобладанием пульсовых волн, синхронизированных с актом дыхания, делают вывод о наличии переходного типа кровотока и оценивают риск развития неопластического процесса в предстательной железе как низкий. При наличии на спектрограмме монофазного, сглаженного по форме огибающей доплеровского спектра кровотока делают вывод о наличии выраженно-атипичного типа кровотока, риск - высокий.
Для подтверждения эффективности предлагаемого способа было обследовано 350 мужчин с гиперплазией простаты и с различным уровнем простатического специфического антигена (ПСА) в периферической крови. Больные были в возрасте от 45 до 68 лет (средний возраст 65,8 года). Гиперплазия простаты была выявлена в результате обследования прикрепленного контингента в соответствии с программой диспансерного наблюдения в рамках обязательного медицинского страхования с включением в скрининг комплексного ультразвукового исследования, а в системе добровольного медицинского страхования - по направлению лечащих врачей.
В контрольную группу вошли 40 мужчин от 55 до 65 лет с различной степенью выраженности гиперплазии предстательной железы, с ПСА до 2 нг/мл и отсутствием «подозрительных участков» при ТРУЗИ. При этом кровоток в простатическом венозном сплетении характеризовался монофазностью и с четкой взаимосвязью с актом дыхания, что соответствовало спектральным характеристикам кровотока в простатическом венозном сплетении у лиц контрольной группы практически здоровых мужчин (Молочков В.А., Ильин И.И. Хронический уретрогенный простатит. - М.: Медицина. - 1998. С.25-37).
Всем больным было проведено комплексное клинико-лабораторное обследование, включавшее изучение жалоб и анамнеза, физикальное обследование, в том числе пальцевое ректальное обследование, лабораторное исследование крови с определением уровня ПСА, мочи, ультразвуковые исследования с включением трансректальной доплерографии. У 148 (42,3%) мужчин в анамнезе были хламидиоз, уреамикоплазменная инфекция, остальные - не отметили перенесенные инфекции.
Трансректальное доплеровское исследование предусматривало трансректальную ультрасонографию кровотока в венах простатического сплетения, цветовое доплеровское картирование, регистрацию и анализ характеристик кровотока в режиме спектрального доплера. Трансректальное ультразвуковое исследование выполнялось по общепринятой методике в положении больного на левом боку. Исследование проводилось на ультразвуковых сканерах: Voluson 730 Expert, Voluson 730 PRO, HDI3500 с применением эндокавитального датчика 7-9 МГц.
При исследовании венозного простатического сплетения у обследованных пациентов с различным уровнем ПСА был выявлен на спектрограмме монофазный псевдопульсирующий кровоток, не синхронизированный с актом дыхания (атипичный тип кровотока), с одной стороны, и монофазный псевдопульсирующий кровоток с преобладанием пульсовых волн, синхронизированных с актом дыхания (переходный тип кровотока), - с другой. Кроме того, был установлен тип кровотока, не выявляемый при инфекционно-воспалительных процессах органов малого таза у мужчин и характеризующийся наличием монофазного, сглаженного по форме огибающей доплеровского спектра кровотока (выраженно-атипичный тип кровотока).
Результаты исследования уровня ПСА в циркулирующей крови показали, что у 212 (60,6%) пациентов он определялся от 4,2 до 4,6 нг/мл, у 108 (30,8%) - от 4,8 до 6,5 нг/мл, у 30 (8,6%) - от 6,8 до 7,5 нг/мл. В таблице приведены данные уровня ПСА, отклонения параметров спектра венозного оттока в простатическом сплетении, полученные в результате определения методами трансректального ультразвукового исследования (ТРУЗИ) и дуплексного сканирования. Таблица демонстрирует, что измененный доплеровский спектр венозного оттока выявлен у всех обследованных мужчин с гиперплазией, при этом «переходный» тип определялся у 212 (60,6%), «атипичный» - у 108 (30,8%), «выраженно-атипичный» - у 30 (8,6%). Серошкальные признаки возможного злокачественного новообразования установлены у 88 (25,1%) пациентов гиперплазией.
| Таблица | ||
| Показатели уровня ПСА и ультразвуковые параметры у обследованных мужчин | ||
| Уровень ПСА (общий) нг/мл | Доплеровский спектр венозного оттока | Серошкальные признаки злокачественного новообразования (ТРУЗИ) |
| 4,2-4,6 (212 чел.) | Переходный (212 чел.) | Не выявлены |
| 4,8-6,5 (108 чел.) | Атипичный (108 чел.) | У 58 пациентов - в периферической зоне и на границе гипоэхогенные образования без четких границ. |
| 6,8-7,5 (30 чел.) | Выраженно-атипичный (30 чел.) | У всех 30 пациентов - гипоэхогенные образования в периферической зоне и на границе зон. |
Пациенты с уровнем ПСА от 4,8 нг/мл до 6,5 нг/мл и атипичным спектром кровотока (108 чел.), а также 58 пациентов с серошкальными признаками возможного неопластического процесса были направлены на биопсию простаты, у 14 (24,1%) из них при первом же исследовании были выявлены атипичные клетки во взятом материале, у 44 - их не было.
Пациенты (30 чел.) с уровнем ПСА от 6,8 нг/мл до 7,5 нг/мл с выраженно-атипичным спектром кровотока также были направлены на биопсию предстательной железы. У данной группы больных при первом же исследовании были выявлены атипичные клетки во взятом материале.
44 пациента с отсутствием атипичных клеток в биопсийном материале и 50 пациентов, не имевших серошкальных признаков возможного неопластического процесса составили группу «повышенного онкориска», которым проводилось динамическое наблюдение один раз в три месяца: исследование уровня ПСА, пальцевое исследование простаты, комплексная ультразвуковая диагностика. Наблюдение за этими больными ведется в течение последних 5 лет.
Пациентов (212 чел.) переходным типом кровотока наблюдали не реже одного раза в год. У 184 (86,8%) из них отмечалась нормализация спектральных характеристик кровотока в венозном простатическом сплетении, снижение уровня ПСА до 4,0 нг/мл и ниже, при отсутствии взаимосвязи с возможным прогрессированием гиперплазии предстательной железы. Остальные 28 (13,2%) пациентов, у которых в процессе динамического наблюдения отмечался рост уровня ПСА относительно ранее выявленных показателей, изменение параметров кровотока в венозном простатическом сплетении по атипичному типу формировали группу «повышенного онкориска» и наблюдались один раз в три месяца, а при выявлении серошкальных признаков неопластического процесса в предстательной железе направлялись на биопсию органа.
По данным отечественных онкологов ПСА не является специфическим маркером рака предстательной железы, что обусловливает одинаковые показатели маркера у пациентов с доброкачественной гиперплазией простаты и начальными формами рака. Частота ложно-положительных значений при доброкачественной гиперплазии простаты при пороговом уровне 4 нг/мл колеблется от 20 до 55%, в связи с этим определяют плотность ПСА, представляющую собой отношение концентрации общего ПСА к объему предстательной железы, определяемому с помощью ТРУЗИ. Учитывая более высокие концентрации ПСА у больных раком по сравнению с доброкачественной гиперплазией простаты при одинаковом объеме железы плотность ПСА теоретически может быть использован для определения вероятности наличия аденокарциномы в нормальной при пальцевом исследовании железе при значениях ПСА 4-10 нг/мл и соответственно, для принятия решения о показаниях к биопсии. Некоторые авторы полагают, что при нормальных данных пальцевого исследования и плотности ПСА < 0,15 нг/мл больного можно оставить под наблюдением. Однако ряд других исследований говорит о ненадежности данного показателя, особенно при учете возрастных колебаний ПСА.
Точность диагностики рака простаты при ректальном пальцевом исследовании составляет 30-50%. Об ограниченности метода при выявлении ранних форм заболевания говорит тот факт, что в 85% случаев локального рака простаты при ПСА в диапазоне 3-4 нг/мл опухоль не пальпируется, а две трети новообразований не пальпируется и не визуализируется при ТРУЗИ.
Около половины узлов рака предстательной железы размерами 1 см не видны при ТРУЗИ, чувствительность метода в оценке стадии составляет 66%, специфичность - 46% (http//netoncology.m/view.php?id=325).
Между тем, результаты наших исследований свидетельствуют, что измененный доплеровский спектр венозного оттока выявляется в 100% случаев у больных доброкачественной гиперплазией при значениях ПСА от 4,2 до 7,5 нг/мл. Дальнейшее повышение уровня ПСА сопровождалось «атипичной» и «выраженно-атипичной» реакцией венозного оттока с наличием, как правило, серошкальных признаков злокачественного новообразования. При этом на показатели гемодинамики в простатическом венозном сплетении в отличие от ПСА не влияют возрастные аспекты.
Таким образом, предлагаемый способ позволяет сформировать группу «повышенного онкориска» из мужчин старше сорока лет и избежать запущенных форм неопластических процессов в предстательной железе на первом этапе амбулаторно-поликлинического обследования населения.
Пример 1. Б-й М-ов П.Г., 44 г. (фиг.1).
При ТРУЗИ: предстательная железа симметричной округлой формы с ровным четким контуром незначительно выступает в просвет мочевого пузыря за счет «отечной средней доли», размеры не увеличены, объем 18 мл (норма до 22 мл), междолевая борозда сглажена. Внутрижелезистая дифференциация сглажена, нарушена мелко-кистозным компонентом с точечными гиперэхогенными включениями, частично сливающимися между собой в периуретральной зоне. Очагов фиброза и кальцинатов нет. Периферическая зона однородная, неравномерной эхогенности, без очаговых изменений. Васкуляризация железы неравномерная. Везикулы не расширены, симметричные.
При дуплексном сканировании: простатическое венозное сплетение расширено до 6 мм, скорость оттока увеличена до 16 см/с. На спектрограмме монофазный псевдопульсирующий кровоток, не синхронизированный с актом дыхания (атипичный тип кровотока). Риск развития неопластического процесса в предстательной железе оценен как средний.
Пример 2. Б-й П-ца И.А., 47 лет (фиг.2).
При ТРУЗИ: предстательная железа симметричной округлой формы, контур ровный, четкий, не выступает в просвет мочевого пузыря, размеры 43×36×38 мм, объем 31 мл, структурность нарушена начальной гиперплазией переходных зон без узлообразования, утолщены до 5 мм, в проекции железистых зон - застойно-воспалительные изменения собственного секрета больше выражены справа, с признаками частичного склерозирования железистой ткани, больше справа. В периферической зоне очаговых изменений нет. Везикулы симметричны, не расширены.
При дуплексном сканировании: простатическое венозное сплетение расширено до 4 мм, вены проходимы, на спектрограмме монофазный псевдопульсирующий кровоток, с преобладанием пульсовых волн, синхронизированных с актом дыхания (переходный тип кровотока). Риск развития неопластического процесса в предстательной железе оценен как низкий.
Пример 3. Б-й Л-ый А.П., 52 г. (фиг.3).
При ТРУЗИ: предстательная железа симметричной округлой формы с ровным четким контуром незначительно выступает в просвет мочевого пузыря, размеры 53×38×41 мм, объем 43 мл. Структурность нарушена узловой гиперплазией переходных зон общим объемом 13 мл, фиброзными изменениями в периуретральной зоне, застойными явлениями собственного секрета. Периферическая зона однородная, без очаговых изменений. Справа на границе зон - относительно гипоэхогенное образование 8 мм с нечетким контуром. Везикулы симметричны, не расширены.
При дуплексном сканировании: простатическое венозное сплетение не расширено, вены проходимы, на спектрограмме монофазный, сглаженный по форме огибающей доплеровского спектра кровоток (выраженно-атипичный тип кровотока). Риск развития неопластического процесса в предстательной железе оценен как высокий.
Способ оценки риска развития неопластического процесса в предстательной железе у мужчин старше сорока лет, заключающийся в проведении трансректального допплеровского исследования венозного простатического сплетения с применением эндокавитального датчика 7-9 МГц, и при наличии на спектрограмме монофазного псевдопульсирующего кровотока, не синхронизированного с актом дыхания, делают вывод о наличии атипичного типа кровотока и оценивают риск развития неопластического процесса в предстательной железе как средний; при наличии на спектрограмме монофазного псевдопульсирующего кровотока с преобладанием пульсовых волн, синхронизированных с актом дыхания, делают вывод о наличии переходного типа кровотока и оценивают риск развития неопластического процесса в предстательной железе как низкий; при наличии на спектрограмме монофазного, сглаженного по форме огибающей допплеровского спектра кровотока делают вывод о наличии выраженно-атипичного типа кровотока, риск - высокий.
www.findpatent.ru
неопластический - это... Что такое неопластический?
неопластический
Слитно или раздельно? Орфографический словарь-справочник. — М.: Русский язык. Б. З. Букчина, Л. П. Какалуцкая. 1998.
- неопластицизм
- неоплатно
Смотреть что такое "неопластический" в других словарях:
неопластический — прил., кол во синонимов: 1 • злокачественный (8) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
неопластический рост — Рост опухолевой ткани [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN neoplastic growth … Справочник технического переводчика
Менингит неопластический — Неопластическая инфильтрация мозговых оболочек может быть карциноматозной, лейкемической и лимфоматозной. Клиническая картина при этом имеет сходство. На первый план выступают интенсивная головная боль, повторная рвота, другие признаки… … Энциклопедический словарь по психологии и педагогике
Тимома — МКБ 10 C37.9, D60 … Википедия
Острые лейкозы — Острые лейкозы группа клональных (онкологических) заболеваний, первично возникающих в костном мозге в результате мутации стволовой клетки крови. Следствием мутации является потеря потомками мутировавшей клетки способности к дифференцировке… … Википедия
Острый лейкоз — Острый лейкоз клональное (онкологическое) заболевание, первично возникающее в костном мозге в результате мутации стволовой клетки крови. Следствием мутации является потеря потомками мутировавшей клетки способности к дифференцировке до… … Википедия
Патологический перелом — Патологический перелом … Википедия
злокачественный — См … Словарь синонимов
Полип (медицина) — Эту статью предлагается разделить на Полип носа, Полип кишечника, Полип матки. Пояснение причин и обсуждение на странице Википедия:К разделению/26 декабря 2012. Возможно, она слишком велика или её содержимое не имеет логической связности, и… … Википедия
ТАМПОНАДА СЕРДЦА — мед. Тампонада сердца скопление жидкости в полости перикарда, вызывающее ограничение наполнения желудочков и предсердий, системный венозный застой и уменьшение сердечного выброса. Этиология • Уремия • Неопластические процессы в грудной полости,… … Справочник по болезням
dic.academic.ru
Поиск по сайту
Email рассылка
Узнавай первым
об обновлениях на сайте по Email БЕСПЛАТНО! Как только на сайте появятся новые посты, видео или фото, Ты сразу же будешь извещен об этом одним из первых.
Новое на сайте
Новое на форуме
Нет сообщений для показа