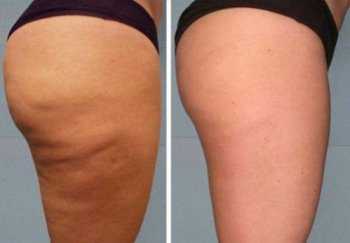
Магний. Что это такое магний
Магний - это... Что такое Магний?
химический элемент главной подгруппы II группы периодической системы Д.И. Менделеева, один из важнейших биоэлементов, необходимый для нормального функционирования организма. Содержание М. в крови является информативным диагностическим тестом при ряде заболеваний.
Атомный номер 12, атомная масса 24,305, валентность +2. В природе встречаются 3 стабильных изотопа магния — 24Mg, 25Mg и 26Mg. Известны 6 радиоактивных изотопов М., из них 5 короткоживущих 20Mg, 21Mg, 22Mg, 23Mg и 27Mg с периодом полураспада от десятых долей секунды до 10 мин и 28Mg с периодом полураспада 21,3 ч (распадается с образованием короткоживущего 28Al), который используют для изучения обмена М. в организме. Магний представляет собой серебристо-белый блестящий металл; t°пл 651°. t°кип 1107°. Химически М. очень активен. На воздухе или в присутствии сильных кислот М. легко окисляется с образованием окисной пленки, предохраняющей его от дальнейшего окисления. При 600—650° горит ослепительно ярким пламенем. М. вступает в реакции с галогенами, вытесняет большинство металлов из их солей и водород из воды и кислот.Для диагностических целей производят определение М. в биологических жидкостях и тканях титриметрическим методом (главным образом методом комплексонометрического титрования) или колориметрически (по интенсивности окраски комплексов М. с азокрасителями). В качестве унифицированного в СССР принят метод определения концентрации М. с ксилидиновым синим (магоном) и титановым желтым (метод Кункеля — Пирсона — Швейгерта). Значительно реже в клинической практике используют методы пламенной фотометрии, атомно-абсорбционной спектрофотометрии и флюориметрический метод определения магния.
Библиогр.: Лабораторные методы исследования в клинике, под ред. В.В. Меньшикова, с. 266, М., 1987; Ноздрюхина Л.Р. Биологическая роль микроэлементов в организме животных и человека, М., 1977.
dic.academic.ru
Магний: Что это такое?
По важности и распространенности в организме человека Магний находится на четвертом месте. Порядка 50% магния в организме
содержится в костях, остальная часть равномерно распределена в клетках организма, и лишь около 1% микроэлемента циркулирует с кровью. Последняя величина не постоянная и зависит от метаболических процессов в организме и количества поступившего элемента в организм с пищей.
Новости 2018-10-03 02:50:59
Новости 2018-10-03 02:50:47
Магний поддерживает около 300 химических реакция и поддерживает правильную мышечную работу, нервную проводимость, сердечный ритм, иммунную регуляцию, обмен сахаров, плотность костей. Снижает артериальное давление и участвует в синтезе белков. Магний из продуктов питания всасывается в тонкой кишке и выводится из организма почками.В каких продуктах содержится магний?
Богатым содержанием магния славятся зеленые овощи и зелень. Молекула хлорофилла содержит элемент в своем составе. Так же много магния содержится в бобовых, орехах, семечковых культурах, неочищенном зерне. Пшеница в неочищенном виде богата магнием, но после удаления зародышевой части и кожуры ( отруби) обедняется. Хлеб из мука высшего сорта беден магнием, а с отрубями- богат. Обычная питьевая вода так же может явиться источником вещества, при наличие в ней солей в высоких концентрациях (жесткая вода). Полноценное, разнообразное питание обеспечивает дневную потребность в элементе.
Таблица содержания магния в продуктах.
|
Продукт |
Содержание (мг) |
% от дневной нормы |
|
Пшеничные отруби, сырые, 1/4 чашки |
89 |
22 |
|
Миндаль, сухой жареный, 30 грамм |
80 |
20 |
|
Шпинат, замороженный, вареный, 1/2 чашки |
78 |
20 |
|
Изюм с хлебными отрубями, 1 стакан |
77 |
19 |
|
Орехи кешью, сухие жареные, 30 грамм |
74 |
19 |
|
Соевые бобы, зрелые, приготовленные, 1/2 чашки |
74 |
19 |
|
Зародыши пшеницы, сырые, 1/4 чашки |
69 |
17 |
|
Орехи, смешанные, сухие жареные, 30 грамм |
64 |
16 |
|
Отруби зерновых, 3/4 чашки |
64 |
16 |
|
Измельченная пшеница, 2 галеты |
61 |
15 |
|
Овсянка быстрого приготовления, обогащенная, на воде, 1 чашка |
61 |
15 |
|
Арахис, сухой жареный, 30 грамм |
50 |
13 |
|
Арахисовое масло, 2 столовые ложки |
49 |
12 |
|
Картофель, запеченный с кожей, 1 средний |
48 |
12 |
|
горох, приготовленный, 1/2 чашки |
46 |
12 |
|
фасоль, вареная, 1/2 чашки |
43 |
11 |
|
Рис, коричневый, длиннозерный, приготовленный, 1/2 чашки |
42 |
11 |
Чечевица, приготовленная, 1/2 чашки |
36 |
9 |
|
печеные бобы, 1/2 чашки |
35 |
9 |
|
Фасоль, консервированная, 1/2 чашки |
35 |
9 |
|
Шоколадное молоко, обезжиренное, 1 чашка |
33 |
8 |
|
Банан, сырой, 1 средний |
32 |
8 |
|
Йогурт, фруктовый, обезжиренный, 250 мл |
32 |
8 |
|
Молочный шоколад плитка |
|
7 |
|
Молоко, обезжиренное 1 чашка |
27 |
7 |
|
Изюм, без косточек, 1/2 чашки |
26 |
7 |
|
Палтус, приготовленный, 90 грамм |
24 |
6 |
|
Хлеб из цельного зерна, 1 ломтик |
23 |
6 |
|
Авокадо, кубики, 1/2 чашки |
22 |
6 |
|
Шоколадный пудинг, 120 грамм |
19 |
5 |
Суточная норма потребления для таблицы 400 мг. Продукты с содержание до 5%- бедные по содержанию магния, больше 20%- богатые.
Потребность человека в магнии.
В таблице указаны значения для удовлетворения потребности организма здоровых людей.
|
Возраст (лет) |
Мужчины (мг / день) |
Женщины (мг / день) |
Беременность (мг / день) |
Лактация (мг / день) |
|
1-3 |
80 |
80 |
N / A |
N / A |
|
4-8 |
130 |
130 |
N / A |
N / A |
9-13 |
240 |
240 |
N / A |
N / A |
|
14-18 |
410 |
360 |
400 |
360 |
|
19-30 |
400 |
310 |
350 |
310 |
|
31 + |
420 |
320 |
360 |
320 |
В таблице указаны значения среднего потребления вещества здоровыми младенцами при грудном вскармливании без существенного влияние на состояние здоровья.
|
Возраст (в месяцах) |
Мужчины и женщины (мг / день) |
|
От 0 до 6 |
30 |
|
От 7 до 12 |
75 |
Причины возникновения магний дефицита и признаки.
Большинство людей в своем ежедневном рационе не всегда получают достаточное количество магния. Благодаря депонированию вещества в тканях возможен его расход для поддержания баланса при недостаточном поступлении магния с пищей и последующее вновь восполнение при богатом потреблении. При длительном недостаточном поступлении элемента с пищей истощаются депо наступает дефицит.
От трети до половины (т.е. только часть из того, что содержится в продуктах усваивается) принятого с пищей магния всасывается в тонкой кишке. Нарушения процессов пищеварения, такие как болезнь крона, сегментарная энтеропатия, целиакия, синдром мальабсорбции- снижают поглощаемость магния. Больные с диареей, рвотой, болезнью крона склонны к магний дефициту.
Повышенное выведение элемента с мочой также может истощить магниевые запасы организма. Некоторые мочегонные препараты, антибиотики, сахарный диабет, алкоголизм увеличивают его выведение с мочой.
Пожилой возраст так же может быть причиной дефицита магния. У возрастных больных низкий уровень потребления продуктов богатых элементом, снижено его усвоение и повышен уровень экскреции с почками.
Признаки дефицита магния включают потерю аппетита, тошноту, рвоту, усталость и слабость. При нарастании дефицита наблюдаются неврологические расстройства- онемение, покалывание, судороги, припадки, изменения личности, нарушение сердечного ритма. Возможны коронарные нарушения, гипертония. Тяжелый дефицит магния может привести к снижению уровня кальция в крови (гипокальциемия) и калия(гипокалиемия), назначение в таких случаях добавок магния может исправить ситуацию.
Всегда следует проводить дополнительные исследования с целью исключения другой патологии со схожими симптомами.
Влияние некоторых лекарств на усвоение и выведение магния.
|
Препарат |
Взаимодействие |
|
Мочегонные препараты (Диуретики): лазикс, бумекс, едекрин и гидрохлоротиазид. Антибиотики: Гентамицин и Амфотерицин Противоопухолевые препараты: цисплатин
|
Увеличивают выведение магния с мочой. При длительном их применении может потребоваться назначение магниевых добавок. |
|
Антибиотики тетрациклинового ряда |
Связывают элемент в кишечники и уменьшают его всасывание. |
|
Магний-содержащие антациды и слабительные. Альмагель, маалокс и пр. |
При частом применении могут повысить уровень магния в крови |
Соединения магния и их биодоступность.
Наилучший способ обеспечения нормального уровня элемента в крови остается полноценный рацион питания. В случае возникновения необходимости восполнения дефицита назначается ряд соединений к которым относятся: оксид магния, сульфат магния и карбонат магния. Введение препаратов осуществляется в форме таблеток, добавок к соли, внутривенных инфузий. Таблетированные и солевые формы могут обладать послабляющим эффектом. С осторожностью следует назначать препараты больным с патологией почек, т.к. у таких пациентов снижено выведения магния с мочой и возникает опасность повышения магния.
Каждое из указанных соединений содержит определенную долю магния и имеет определенную биодоступность, что в конечном итоге будет указывать на эффективность этих добавок. Использование кишечно-растворимых покрытий для пероральных препаратов способствует попаданию вещества в кишечник, минуя желудочную среду, где может происходить связывание и потеря магния. Наибольшую долю(60%) содержит оксид магния, но обладает наименьшей биодоступностью. Наибольшая биодоступность у хлорида и лактата магния, доля магния в них по 12%. Гидрооксид магния содержит 42%, карбонат 29%, цитрат 16%, сульфат 10%.
Передозировка магния.
Немного вынужденной рекламы. Мы существуем за счет рекламы.
Обычное питание не создает риска возникновения повышенного содержания магния. Опасность представляют дополнительные введения вещества, особенно при нарушениях его выведения. При превышении допустимых норм потребления возможно появление тошноты, потери аппетита, диареи, спастических болей в животе, мышечной слабости, нарушения дыхания и сердечного ритма, падение АД, в тяжелых случаях развитие неврологической патологии.
Максимально допустимые суточные дозы магния при приеме добавок.
|
Возраст (лет) |
Мужчины (мг / день) |
Женщины (мг / день) |
Беременность (мг / день) |
Лактация (мг / день) |
|
Младенцы |
Неопределенный |
Неопределенный |
N / A |
N / A |
|
1-3 |
65 |
65 |
N / A |
N / A |
|
4-8 |
110 |
110 |
N / A |
N / A |
|
9-18 |
350 |
350 |
350 |
350 |
|
19 + |
350 |
350 |
350 |
350 |
pro-medica.ru
Магний - это... Что такое Магний?
| Лёгкий, ковкий, серебристо-белый металл | |
| Магний / Magnesium (Mg), 12 | |
| 24,305 а. е. м. (г/моль) | |
| [Ne] 3s2 | |
| 160 пм | |
| 136 пм | |
| 66 (+2e) пм | |
| 1,31 (шкала Полинга) | |
| −2,37 В | |
| 2 | |
| 737,3 (7,64) кДж/моль (эВ) | |
| 1,737 г/см³ | |
| 650 по Цельсию | |
| 1105 по Цельсию | |
| 9,20 кДж/моль | |
| 131,8 кДж/моль | |
| 24,90[1] Дж/(K·моль) | |
| 14,0 см³/моль | |
| гексагональная | |
| a=0,32029 нм, c=0,52000 нм Å | |
| 1,624 | |
| 318 K | |
| (300 K) 156 Вт/(м·К) | |
Ма́гний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg (лат. Magnesium). Простое вещество магний (CAS-номер: 7439-95-4) — лёгкий, ковкий металл серебристо-белого цвета.
История
Происхождение названия
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари называли её горькой солью, а также английской, или эпсомской солью. Минерал эпсомит имеет состав MgSO4 · 7h3O. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
В 1792 году Антон фон Рупрехт получил новый металл, названный им австрием, восстановлением углём из белой магнезии. Позже было установлено, что «австрий» представляет собой магний крайне низкой степени чистоты, поскольку исходное вещество была сильно загрязнёно железом[2].
Впервые был выделен в чистом виде сэром Гемфри Дэви в 1808 году дистилляцией ртути из магниевой амальгамы, которую он получил электролизом полужидкой смеси оксида магния и ртути.
Нахождение в природе
Кларк магния 19 кг/т. Это один из самых распространённых элементов земной коры. Большие количества магния находятся в морской воде. Главными видами нахождения магнезиального сырья являются:
- морская вода — (Mg 0,12-0,13 %),
- карналлит — MgCl2 • KCl • 6h3O (Mg 8,7 %),
- бишофит — MgCl2 • 6h3O (Mg 11,9 %),
- кизерит — MgSO4 • h3O (Mg 17,6 %),
- эпсомит — MgSO4 • 7h3O (Mg 16,3 %),
- каинит — KCl • MgSO4 • 3h3O (Mg 9,8 %),
- магнезит — MgCO3 (Mg 28,7 %),
- доломит — CaCO3·MgCO3 (Mg 13,1 %),
- брусит — Mg(OH)2 (Mg 41,6 %).
Магнезиальные соли встречаются в больших количествах в солевых отложениях самосадочных озёр. Месторождения ископаемых солей карналлита осадочного происхождения известны во многих странах.
Магнезит образуется преимущественно в гидротермальных условиях и относится к среднетемпературным гидротермальным месторождениям. Доломит также является важным магниевым сырьём. Месторождения доломита широко распространены, запасы их огромны. Они ассоциируют с карбонатными толщами и большинство из них имеет докембрийский или пермский возраст. Доломитовые залежи образуются осадочным путём, но могут возникать также при воздействии на известняки гидротермальных растворов, подземных или поверхностных вод.
Типы месторождений
Природные источники магния:
Большая часть мировой добычи магния сосредоточена в США (43 %), странах СНГ (26 %) и Норвегии (17 %), возрастает доля Китая[3].
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В расплаве электрохимическому восстановлению подвергается хлорид магния:
MgCl2 (электролиз) = Mg + Cl2.
Расплавленный металл периодически отбирают из электролизной ванны, а в неё добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много (около 0,1 %) примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс:
MgO + C = Mg + CO
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
CaCO3·MgCO3 = CaO + MgO + 2CO2,
2MgO + CaO + Si = CaSiO3 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду.
Физические свойства
Магний — металл серебристо-белого цвета с гексагональной решёткой, обладает металлическим блеском; пространственная группа P 63/mmc, параметры решётки a = 0,32029 нм, c = 0,52000 нм, Z = 2. При обычных условиях поверхность магния покрыта прочной защитной плёнкой оксида магния MgO, которая разрушается при нагреве на воздухе до примерно 600 °C, после чего металл сгорает с ослепительно белым пламенем с образованием оксида и нитрида магния Mg3N2. Плотность магния при 20 °C — 1,737 г/см³, температура плавления металла tпл = 651 °C, температура кипения tкип = 1103 °C, теплопроводность при 20 °C — 156 Вт/(м·К).
Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддаётся обработке резанием.
Химические свойства
Смесь порошкового магния с перманганатом калия KMnO4 — взрывчатое вещество
Раскаленный магний реагирует с водой:Mg + Н2О = MgO + h3↑Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:Mg + 2HCl = MgCl2 + h3При нагревании на воздухе магний сгорает с образованием оксида и небольшого количества нитрида. При этом выделяется большое количество теплоты и световой энергии:2Mg + О2 = 2MgO3Mg + N2 = Mg3N2Магний может гореть даже в углекислом газе:2Mg + CO2 = 2MgO + C
Горящий магний нельзя тушить водой.
Применение
Применяется для восстановления металлического титана из тетрахлорида титана. Используется для получения лёгких и сверхлёгких сплавов (самолётостроение, производство автомобилей), а также для изготовления осветительных и зажигательных ракет.
Сплавы
Сплавы на основе магния являются важным конструкционным материалом в авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Цены на магний в слитках в 2006 году составили в среднем 3 долл/кг. В 2012 году цены на магний составляют порядка 2,8-2,9 долл./кг.
Химические источники тока
Магний в виде чистого металла, а также его химические соединения (бромид, перхлорат) применяются для производства очень мощных резервных электрических батарей (например, магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др.) и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др.). Химические источники тока на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высоким разрядным напряжением.
Соединения
Гидрид магния — один из наиболее ёмких аккумуляторов водорода, применяемых для его хранения.
Огнеупорные материалы
Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
Перхлорат магния, Mg(ClO4)2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с участием магния.
Фторид магния MgF2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния MgBr2 — в качестве электролита для химических резервных источников тока.
Военное дело
Свойство магния гореть белым ослепительным пламенем широко используется в военной технике для изготовления осветительных и сигнальных ракет, трассирующих пуль и снарядов, зажигательных бомб. В смеси с соответствующими окислителями он также является основным компонентом заряда светошумовых боеприпасов.
Медицина
Магний является жизненно-важным элементом, который находится во всех тканях организма и необходим для нормального функционирования клеток. Участвует в большинстве реакций обмена веществ, в регуляции передачи нервных импульсов и в сокращении мышц, оказывает спазмолитическое и антиагрегантное действие. Оксид и соли магния традиционно применяется в медицине в кардиологии, неврологии и гастроэнтерологии (аспаркам, сульфат магния, цитрат магния. Наиболее интересным природным ресурсом магния является минерал бишофит). Оказалось, что магниевые эффекты бишофита в первую очередь проявляются при транскутанном (через кожном) применении в лечении патологии опорно-двигательного аппарата. Бишофитотерапия использует биологические эффекты природного магния в лечении и реабилитации широкого круга заболеваний, в первую очередь — позвоночника и суставов, последствий травм, нервной и сердечно-сосудистой систем.
Фотография
Магниевый порошок с окисляющими добавками (нитрат бария, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Аккумуляторы
Магниево-серные батареи — являются одними из самых перспективных, превосходя в теории ёмкость ионо-литиевых, однако, пока эта технологи находится на стадии лабораторных исследований в силу непреодолённости некоторых технических препятствий.[4]
Биологическая роль и токсикология
Магний — один из важных биогенных элементов, в значительных количествах содержится в тканях животных и растений (хлорофиллы). Его биологическая роль сформировалась исторически, в период зарождения и развития протожизни на нашей планете в связи с тем, что морская среда первобытной земли была преимущественно хлоридно-магниевая, в отличие от нынешней — хлоридно-натриевой.
Магний — часть солевого баланса живых организмов: недостаток магния ухудшает усвоение других микроэлементов, избыток — их вымывание (замещение)[5][неавторитетный источник?]. Магний является кофактором многих ферментативных реакций. Магний необходим для превращения креатина фосфата в АТФ — нуклеотид, являющийся универсальным поставщиком энергии в живых клетках организма. Магний необходим на всех этапах синтеза белка.
Дефицит магния может проявляться по-разному: бессонница, хроническая усталость, остеопороз, артрит, фибромиалгия, мигрень, мышечные судороги и спазмы, сердечная аритмия, запоры, предменструальный синдром (ПМС). При потливости, частом употреблении слабительных и мочегонных, алкоголя, больших психических и физических нагрузках (в первую очередь при стрессах и у спортсменов) потребность в магнии увеличивается.
К пище, богатой магнием, относятся: кунжут, отруби, орехи. Магния совсем мало в хлебе, молочных, мясных и других повседневных продуктах питания современного человека. Суточная норма магния — порядка 300 мг для женщин и 400 мг для мужчин. По результатам последних исследований обнаружено, что цитрат магния является наиболее усваиваемым продуктом, содержащим магний[6][7].
Одним из наиболее биологически целесообразных источников магния при транскутанном (чрезкожном) всасывании является минерал бишофит, широко использующийся в целях медицинской реабилитации, физиотерапии и санаторно-курортного лечения. Преимуществом транскутанного применения является высокая биодоступность ионов магния, насыщающего локальные проблемные зоны минуя выделительную систему.
Примечания
Литература
- Эйдензон М. А., Магний, М., 1969; Тихонов В. Н.
- Аналитическая химия магния, М., 1973 Иванов А. И., Ляндрес М. Б., Прокофьев О. В.
- Производство магния, М., 1979. С. И. Дракин. П. М. Чукуров.
- Дэвис А. Нутрицевтика. Питание для жизни, здоровья и долголетия. — М.: Саттва, Институт трансперсональной психологии, 2004. — С.180—188. — ISBN.5-93509-021-X
- Минделл Э. Справочник по витаминам и минеральным веществам. — М.: Медицина и питание, 2000. — С.83—85. — ISBN.5-900059-03-0
Ссылки
| Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, h3, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
dik.academic.ru
Магний - это... Что такое Магний?
| Лёгкий, ковкий, серебристо-белый металл | |
| Магний / Magnesium (Mg), 12 | |
| 24,305 а. е. м. (г/моль) | |
| [Ne] 3s2 | |
| 160 пм | |
| 136 пм | |
| 66 (+2e) пм | |
| 1,31 (шкала Полинга) | |
| −2,37 В | |
| 2 | |
| 737,3 (7,64) кДж/моль (эВ) | |
| 1,737 г/см³ | |
| 650 по Цельсию | |
| 1105 по Цельсию | |
| 9,20 кДж/моль | |
| 131,8 кДж/моль | |
| 24,90[1] Дж/(K·моль) | |
| 14,0 см³/моль | |
| гексагональная | |
| a=0,32029 нм, c=0,52000 нм Å | |
| 1,624 | |
| 318 K | |
| (300 K) 156 Вт/(м·К) | |
Ма́гний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg (лат. Magnesium). Простое вещество магний (CAS-номер: 7439-95-4) — лёгкий, ковкий металл серебристо-белого цвета.
История
Происхождение названия
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари называли её горькой солью, а также английской, или эпсомской солью. Минерал эпсомит имеет состав MgSO4 · 7h3O. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
В 1792 году Антон фон Рупрехт получил новый металл, названный им австрием, восстановлением углём из белой магнезии. Позже было установлено, что «австрий» представляет собой магний крайне низкой степени чистоты, поскольку исходное вещество была сильно загрязнёно железом[2].
Впервые был выделен в чистом виде сэром Гемфри Дэви в 1808 году дистилляцией ртути из магниевой амальгамы, которую он получил электролизом полужидкой смеси оксида магния и ртути.
Нахождение в природе
Кларк магния 19 кг/т. Это один из самых распространённых элементов земной коры. Большие количества магния находятся в морской воде. Главными видами нахождения магнезиального сырья являются:
- морская вода — (Mg 0,12-0,13 %),
- карналлит — MgCl2 • KCl • 6h3O (Mg 8,7 %),
- бишофит — MgCl2 • 6h3O (Mg 11,9 %),
- кизерит — MgSO4 • h3O (Mg 17,6 %),
- эпсомит — MgSO4 • 7h3O (Mg 16,3 %),
- каинит — KCl • MgSO4 • 3h3O (Mg 9,8 %),
- магнезит — MgCO3 (Mg 28,7 %),
- доломит — CaCO3·MgCO3 (Mg 13,1 %),
- брусит — Mg(OH)2 (Mg 41,6 %).
Магнезиальные соли встречаются в больших количествах в солевых отложениях самосадочных озёр. Месторождения ископаемых солей карналлита осадочного происхождения известны во многих странах.
Магнезит образуется преимущественно в гидротермальных условиях и относится к среднетемпературным гидротермальным месторождениям. Доломит также является важным магниевым сырьём. Месторождения доломита широко распространены, запасы их огромны. Они ассоциируют с карбонатными толщами и большинство из них имеет докембрийский или пермский возраст. Доломитовые залежи образуются осадочным путём, но могут возникать также при воздействии на известняки гидротермальных растворов, подземных или поверхностных вод.
Типы месторождений
Природные источники магния:
Большая часть мировой добычи магния сосредоточена в США (43 %), странах СНГ (26 %) и Норвегии (17 %), возрастает доля Китая[3].
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В расплаве электрохимическому восстановлению подвергается хлорид магния:
MgCl2 (электролиз) = Mg + Cl2.
Расплавленный металл периодически отбирают из электролизной ванны, а в неё добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много (около 0,1 %) примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс:
MgO + C = Mg + CO
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
CaCO3·MgCO3 = CaO + MgO + 2CO2,
2MgO + CaO + Si = CaSiO3 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду.
Физические свойства
Магний — металл серебристо-белого цвета с гексагональной решёткой, обладает металлическим блеском; пространственная группа P 63/mmc, параметры решётки a = 0,32029 нм, c = 0,52000 нм, Z = 2. При обычных условиях поверхность магния покрыта прочной защитной плёнкой оксида магния MgO, которая разрушается при нагреве на воздухе до примерно 600 °C, после чего металл сгорает с ослепительно белым пламенем с образованием оксида и нитрида магния Mg3N2. Плотность магния при 20 °C — 1,737 г/см³, температура плавления металла tпл = 651 °C, температура кипения tкип = 1103 °C, теплопроводность при 20 °C — 156 Вт/(м·К).
Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддаётся обработке резанием.
Химические свойства
Смесь порошкового магния с перманганатом калия KMnO4 — взрывчатое вещество
Раскаленный магний реагирует с водой:Mg + Н2О = MgO + h3↑Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:Mg + 2HCl = MgCl2 + h3При нагревании на воздухе магний сгорает с образованием оксида и небольшого количества нитрида. При этом выделяется большое количество теплоты и световой энергии:2Mg + О2 = 2MgO3Mg + N2 = Mg3N2Магний может гореть даже в углекислом газе:2Mg + CO2 = 2MgO + C
Горящий магний нельзя тушить водой.
Применение
Применяется для восстановления металлического титана из тетрахлорида титана. Используется для получения лёгких и сверхлёгких сплавов (самолётостроение, производство автомобилей), а также для изготовления осветительных и зажигательных ракет.
Сплавы
Сплавы на основе магния являются важным конструкционным материалом в авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Цены на магний в слитках в 2006 году составили в среднем 3 долл/кг. В 2012 году цены на магний составляют порядка 2,8-2,9 долл./кг.
Химические источники тока
Магний в виде чистого металла, а также его химические соединения (бромид, перхлорат) применяются для производства очень мощных резервных электрических батарей (например, магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др.) и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др.). Химические источники тока на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высоким разрядным напряжением.
Соединения
Гидрид магния — один из наиболее ёмких аккумуляторов водорода, применяемых для его хранения.
Огнеупорные материалы
Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
Перхлорат магния, Mg(ClO4)2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с участием магния.
Фторид магния MgF2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния MgBr2 — в качестве электролита для химических резервных источников тока.
Военное дело
Свойство магния гореть белым ослепительным пламенем широко используется в военной технике для изготовления осветительных и сигнальных ракет, трассирующих пуль и снарядов, зажигательных бомб. В смеси с соответствующими окислителями он также является основным компонентом заряда светошумовых боеприпасов.
Медицина
Магний является жизненно-важным элементом, который находится во всех тканях организма и необходим для нормального функционирования клеток. Участвует в большинстве реакций обмена веществ, в регуляции передачи нервных импульсов и в сокращении мышц, оказывает спазмолитическое и антиагрегантное действие. Оксид и соли магния традиционно применяется в медицине в кардиологии, неврологии и гастроэнтерологии (аспаркам, сульфат магния, цитрат магния. Наиболее интересным природным ресурсом магния является минерал бишофит). Оказалось, что магниевые эффекты бишофита в первую очередь проявляются при транскутанном (через кожном) применении в лечении патологии опорно-двигательного аппарата. Бишофитотерапия использует биологические эффекты природного магния в лечении и реабилитации широкого круга заболеваний, в первую очередь — позвоночника и суставов, последствий травм, нервной и сердечно-сосудистой систем.
Фотография
Магниевый порошок с окисляющими добавками (нитрат бария, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Аккумуляторы
Магниево-серные батареи — являются одними из самых перспективных, превосходя в теории ёмкость ионо-литиевых, однако, пока эта технологи находится на стадии лабораторных исследований в силу непреодолённости некоторых технических препятствий.[4]
Биологическая роль и токсикология
Магний — один из важных биогенных элементов, в значительных количествах содержится в тканях животных и растений (хлорофиллы). Его биологическая роль сформировалась исторически, в период зарождения и развития протожизни на нашей планете в связи с тем, что морская среда первобытной земли была преимущественно хлоридно-магниевая, в отличие от нынешней — хлоридно-натриевой.
Магний — часть солевого баланса живых организмов: недостаток магния ухудшает усвоение других микроэлементов, избыток — их вымывание (замещение)[5][неавторитетный источник?]. Магний является кофактором многих ферментативных реакций. Магний необходим для превращения креатина фосфата в АТФ — нуклеотид, являющийся универсальным поставщиком энергии в живых клетках организма. Магний необходим на всех этапах синтеза белка.
Дефицит магния может проявляться по-разному: бессонница, хроническая усталость, остеопороз, артрит, фибромиалгия, мигрень, мышечные судороги и спазмы, сердечная аритмия, запоры, предменструальный синдром (ПМС). При потливости, частом употреблении слабительных и мочегонных, алкоголя, больших психических и физических нагрузках (в первую очередь при стрессах и у спортсменов) потребность в магнии увеличивается.
К пище, богатой магнием, относятся: кунжут, отруби, орехи. Магния совсем мало в хлебе, молочных, мясных и других повседневных продуктах питания современного человека. Суточная норма магния — порядка 300 мг для женщин и 400 мг для мужчин. По результатам последних исследований обнаружено, что цитрат магния является наиболее усваиваемым продуктом, содержащим магний[6][7].
Одним из наиболее биологически целесообразных источников магния при транскутанном (чрезкожном) всасывании является минерал бишофит, широко использующийся в целях медицинской реабилитации, физиотерапии и санаторно-курортного лечения. Преимуществом транскутанного применения является высокая биодоступность ионов магния, насыщающего локальные проблемные зоны минуя выделительную систему.
Примечания
Литература
- Эйдензон М. А., Магний, М., 1969; Тихонов В. Н.
- Аналитическая химия магния, М., 1973 Иванов А. И., Ляндрес М. Б., Прокофьев О. В.
- Производство магния, М., 1979. С. И. Дракин. П. М. Чукуров.
- Дэвис А. Нутрицевтика. Питание для жизни, здоровья и долголетия. — М.: Саттва, Институт трансперсональной психологии, 2004. — С.180—188. — ISBN.5-93509-021-X
- Минделл Э. Справочник по витаминам и минеральным веществам. — М.: Медицина и питание, 2000. — С.83—85. — ISBN.5-900059-03-0
Ссылки
| Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, h3, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
brokgauz.academic.ru
магний - это... Что такое магний?
МА́ГНИЙ -я; м. [лат. magnium] Химический элемент (Mg), лёгкий ковкий металл серебристо-белого цвета, горящий ярким белым пламенем. Окись магния. Вспышка магния.
◁ Ма́гниевый, -ая, -ое. М-ые руды. М. сплав.
МА́ГНИЙ (лат. Magnesium), Mg (читается «магний»), химический элемент IIА группы третьего периода периодической системы Менделеева (см. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ МЕНДЕЛЕЕВА), атомный номер 12, атомная масса 24,305. Природный магний состоит из трех стабильных нуклидов (см. НУКЛИД): 24Mg (78,60% по массе), 25Mg (10,11%) и 26Mg (11,29%). Электронная конфигурация нейтрального атома 1s22s2p63s2, согласно которой магний в стабильных соединениях двухвалентен (степень окисления +2). Простое вещество магний — легкий, серебристо-белый блестящий металл. История открытия Соединения магния были известны человеку с давних пор. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита (см. МАГНЕЗИТ). Металлический магний впервые получил в 1808 английский химик Г. Дэви (см. ДЭВИ Гемфри). Как и в случае других активных металлов — натрия, калия, кальция, для получения металлического магния Дэви использовал электролиз. Электролизу он подвергал увлажненную смесь белой магнезии (в ее состав, судя по всему, входили оксид магния MgO и гидроксид магния Mg(OH)2) и оксида ртути HgO. В результате Дэви получил амальгаму — сплав нового металла со ртутью. После отгонки ртути остался порошок нового металла, который Дэви назвал магнием. Магний, полученный Дэви, был довольно грязным, чистый металлический магний получен впервые в 1828 французским химиком А. Бюсси. Нахождение в природе Магний — один из десяти наиболее распространенных элементов земной коры. В ней содержится 2,35% магния по массе. Из-за высокой химической активности в свободном виде магний не встречается, а входит в состав множества минералов — силикатов, алюмосиликатов, карбонатов, хлоридов, сульфатов и др. Так, магний содержат широко распространенные силикаты оливин (см. ОЛИВИН) (Mg,Fe)2[SiO4] и серпентин (см. СЕРПЕНТИН) Mg6(OH)8[Si4O10]. Важное практическое значение имеют такие магнийсодержащие минералы, как асбест (см. АСБЕСТ (минерал)), магнезит (см. МАГНЕЗИТ), доломит (см. ДОЛОМИТ) MgCO3·CaCO3, бишофит (см. БИШОФИТ) MgCl2·6h3O, карналлит (см. КАРНАЛЛИТ) KCl·MgCl2·6h3O, эпсомит (см. ЭПСОМИТ) MgSO4·7h3O, каинит (см. КАИНИТ) KCl·MgSO4·3h3O, астраханит Na2SO4·MgSO4·4h3O и др. Магний содержится в морской воде (4% Mg в сухом остатке), в природных рассолах, во многих подземных водах. Получение Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2, натрия NaCl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния: MgCl2 (электролиз) = Mg + Cl2. Расплавленный металл периодически отбирают из электролизной ванны, а в нее добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много — около 0,1% примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния, или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999% и выше. Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс: MgO + C = Mg + CO или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции: CaCO3·MgCO3 = CaO + MgO + 2CO2, 2MgO + 2CaO + Si = Ca2SiO4 + 2Mg. Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду. Физические и химические свойства Металлический магний обладает гексагональной кристаллической решеткой. Температура плавления 650°C, температура кипения 1105°C, плотность 1,74 г/см3 (магний — очень легкий металл, легче только кальций и щелочные металлы (см. ЩЕЛОЧНЫЕ МЕТАЛЛЫ)). Стандартный электродный потенциал магния Mg/Mg2+ –2,37В. В ряду стандартных потенциалов он расположен за натрием перед алюминием. Поверхность магния покрыта плотной пленкой оксида MgO, при обычных условиях надежно защищающей металл от дальнейшего разрушения. Только при нагревании металла до температуры выше примерно 600°C он загорается на воздухе. Горит магний с испусканием яркого света, по спектральному составу близкого к солнечному. Поэтому раньше фотографы при недостаточной освещенности проводили съемку в свете горящей ленты магния. При горении магния на воздухе образуется рыхлый белый порошок оксида магния MgO: 2Mg + O2 = 2MgO. Одновременно с оксидом образуется и нитрид магния Mg3N2: 3Mg + N2 = Mg3N2. C холодной водой магний не реагирует (или, точнее, реагирует, но крайне медленно), а с горячей водой он вступает во взаимодействие, причем образуется рыхлый белый осадок гидроксида магния Mg(OH)2: Mg + 2h3O = Mg(OH)2 + h3. Если ленту магния поджечь и опустить в стакан с водой, то горение металла продолжается. При этом выделяющийся при взаимодействии магния с водой водород немедленно загорается на воздухе. Горение магния продолжается и в атмосфере углекислого газа: 2Mg + CO2 = 2MgO + C. Способность магния гореть как в воде, так и в атмосфере углекислого газа существенно усложняет тушение пожаров, при которых горят конструкции из магния или его сплавов. (см. МАГНИЯ ОКСИД) Оксид магния (см. МАГНИЯ ОКСИД) MgO представляет собой белый рыхлый порошок, не реагирующий с водой. Раньше его называли жженой магнезией или просто магнезией. Этот оксид обладает основными свойствами, он реагирует с различными кислотами, например: MgO + 2HNO3 = Mg(NO3)2 + h3O. Отвечающее этому оксиду основание Mg(OH)2 — средней силы, но в воде практически нерастворимо. Его можно получить, например, добавляя щелочь к раствору какой-либо соли магния: 2NaOH + MgSO4 = Mg(OH)2 + Na2SO4. Так как оксид магния MgO при взаимодействии с водой щелочей не образует, а основание магния Mg(OH)2 щелочными свойствами не обладает, магний, в отличие от своих «согруппников» — кальция, стронция и бария, не относится к числу щелочноземельных металлов. Металлический магний при комнатной температуре реагирует с галогенами, например, с бромом: Mg + Br2 = MgBr2. При нагревании магний вступает во взаимодействие с серой, давая сульфид магния: Mg + S = MgS. Если в инертной атмосфере прокаливать смесь магния и кокса, то образуется карбид магния состава Mg2C3 (следует отметить, что ближайший сосед магния по группе — кальций — в аналогичных условиях образует карбид состава СаС2). При разложении карбида магния водой образуется гомолог ацетилена — пропин С3Н4: Mg2C3 + 4Н2О = 2Mg(OH)2 + С3Н4. Поэтому Mg2C3 можно назвать пропиленидом магния. В поведении магния есть черты сходства с поведением щелочного металла лития (см. ЛИТИЙ) (пример диагонального сходства элементов в таблице Менделеева). Так, магний, как и литий, реагирует с азотом (реакция магния с азотом протекает при нагревании), в результате образуется нитрид магния: 3Mg + N2= Mg3N2. Как и нитрид лития, нитрид магния легко разлагается водой: Mg3N2 + 6Н2О = 3Mg(ОН)2 + 2NН3. Сходство с литием проявляется у магния и в том, что его карбонат MgCO3 и фосфат Mg3(PO4)2 в воде плохо растворимы, как и соответствующие соли лития. С кальцием магний сближает то, что присутствие в воде растворимых гидрокарбонатов этих элементов обусловливает жесткость воды (см. ЖЕСТКОСТЬ ВОДЫ). Как и в случае гидрокарбоната кальция (см. ст. Кальций (см. КАЛЬЦИЙ)), жесткость, вызванная гидрокарбонатом магния Mg(HCO3)2, — временная. При кипячении гидрокарбонат магния Mg(HCO3)2 разлагается и в осадок выпадает его основной карбонат — гидроксокарбонат магния (MgOH)2CO3: 2Mg(HCO3)2 = (MgOH)2CO3 + 3CO2 + Н2О. Практическое применение до сих пор имеет перхлорат магния Mg(ClO4)2, энергично взаимодействующий с парами воды, хорошо осушающий воздух или другой газ, проходящий через его слой. При этом образуется прочный кристаллогидрат Mg(ClO4)2·6Н2О. Это вещество можно вновь обезводить, нагревая в вакууме при температуре около 300°C. За свойства осушителя перхлорат магния получил название «ангидрон». Большое значение в органической химии имеют магнийорганические соединения (см. МАГНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ), содержащие связь Mg—C. Особенно важную роль среди них играет так называемый реактив Гриньяра — соединения магния общей формулы RMgHal, где R — органический радикал, а Hal = Cl, Br или I. Эти соединения образуются в эфирных растворах при взаимодействии магния и соответствующего органического галоида RHal и используются для самых разнообразных синтезов. Применение Основная часть добываемого магния используется для получения различных легких магниевых сплавов. В состав этих сплавов, кроме магния, входят, как правило, алюминий, цинк, цирконий. Такие сплавы достаточно прочны и находят применение в самолетостроении, приборостроении и для других целей. Высокая химическая активность металлического магния позволяет использовать его при магниетермическом получении таких металлов, как титан, цирконий, ванадий, уран и др. При этом магний реагирует с оксидом или фторидом получаемого металла, например: 2Mg + TiO2 = 2MgO + Ti. 2Mg + UF4 = 2MgF2 + U. Широкое применение находят многие соединения магния, особенно его оксид, карбонат и сульфат. Биологическая роль магния Магний — биогенный элемент (см. БИОГЕННЫЕ ЭЛЕМЕНТЫ), постоянно присутствующий в тканях всех организмов. Он входит в состав молекулы зеленого пигмента растений — хлорофилла (см. ХЛОРОФИЛЛ), участвует в минеральном обмене, активирует ферментные процессы в организме, повышает засухоустойчивость растений. С участием ионов Mg+осуществляется биолюминесценция (см. БИОЛЮМИНЕСЦЕНЦИЯ) и ряд других биологических процессов. Широкое практическое применение находят магниевые удобрения — доломитовая мука, жженая магнезия и др. В организм животных и человека магний поступает с пищей. Суточная потребность человека в магнии — 0,3—0,5 г. В организме среднего человека (масса тела 70 кг) содержится около 19 г магния. Нарушения обмена магния приводят к различным заболеваниям. В медицине применяют препараты магния — его сульфат, карбонат, жженую магнезию.en.academic.ru
МАГНИЙ - это... Что такое МАГНИЙ?
МАГНИЙ — (ново лат. magnium, от лат. magnesia). Серебристый металл, составляющий основание магнезии. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. МАГНИЙ блестящий металл серебристо белого цвета, горит очень ярким белым… … Словарь иностранных слов русского языка
МАГНИЙ — (Magnesium), Mg, химический элемент II группы периодической системы, атомный номер 12, атомная масса 24,305; относится к щелочно земельным металлам; tпл 650шC. Входит в состав хлорофилла. Магний компонент сплавов, осветительных и зажигательных… … Современная энциклопедия
МАГНИЙ — (символ Mg), металлический элемент серебристо белого цвета, один из ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ. Восьмой по распространенности элемент земной коры. Впервые был выделен в 1808 г. Хэмфри ДЭВИ. Необходим в питании человека и животных. Магний всегда… … Научно-технический энциклопедический словарь
Магний — (Magnesium), Mg, химический элемент II группы периодической системы, атомный номер 12, атомная масса 24,305; относится к щелочно земельным металлам; tпл 650°C. Входит в состав хлорофилла. Магний компонент сплавов, осветительных и зажигательных… … Иллюстрированный энциклопедический словарь
МАГНИЙ — МАГНИЙ, см. магнезия. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
МАГНИЙ — (лат. Magnesium) Mg, химический элемент II группы периодической системы, атомный номер 12, атомная масса 24,305. Название от новолатинского magnesia магнезия. Серебристый металл, очень легкий и прочный; плотность 1,74 г/см³, tпл 650 .С. На… … Большой Энциклопедический словарь
Магний — Mg (лат. Magnesium * a. magnesium; н. Magnesium; ф. magnesium; и. magnesio), хим. элемент II группы периодич. системы Менделеева, ат. н. 12, ат. м. 24,312. Природный M. состоит из смеси стабильных изотопов 24Mg (78,6%), 25Mg (10,11%) и… … Геологическая энциклопедия
МАГНИЙ — МАГНИЙ, магния, мн. нет, муж. (ново лат. magnium) (хим.). Мягкий серебристо белый металл, горящий белым ослепительным пламенем. Группа снята вечером при вспышке магния. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
МАГНИЙ — МАГНИЙ, я, муж. Химический элемент, мягкий лёгкий серебристо белый металл, горящий ярким белым светом. | прил. магниевый, ая, ое. Магниевая вспышка. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
МАГНИЙ — (лат. Magnesium), Mg, хим. элемент II группы периодич. системы элементов; ат. номер 12, ат. масса 24,305. Природный М. содержит 3 стабильных изотопа: 24Mg (78,99%), 25Mg (10,00%) и 26Mg (11,01%). Электронная конфигурация внеш. оболочки 3s2.… … Физическая энциклопедия
МАГНИЙ — серебристо белого цвета легкий металл (уд. вес 1,74), близкий по свойствам к алюминию. Темп pa плавления 650°; сопротивление на разрыв 12 кг/мм2; горит ярким пламенем. В промышленности находит все более широкое распространение при изготовлении… … Технический железнодорожный словарь
big_medicine.academic.ru
магний - это... Что такое магний?
МА́ГНИЙ -я; м. [лат. magnium] Химический элемент (Mg), лёгкий ковкий металл серебристо-белого цвета, горящий ярким белым пламенем. Окись магния. Вспышка магния.
◁ Ма́гниевый, -ая, -ое. М-ые руды. М. сплав.
МА́ГНИЙ (лат. Magnesium), Mg (читается «магний»), химический элемент IIА группы третьего периода периодической системы Менделеева (см. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ МЕНДЕЛЕЕВА), атомный номер 12, атомная масса 24,305. Природный магний состоит из трех стабильных нуклидов (см. НУКЛИД): 24Mg (78,60% по массе), 25Mg (10,11%) и 26Mg (11,29%). Электронная конфигурация нейтрального атома 1s22s2p63s2, согласно которой магний в стабильных соединениях двухвалентен (степень окисления +2). Простое вещество магний — легкий, серебристо-белый блестящий металл. История открытия Соединения магния были известны человеку с давних пор. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита (см. МАГНЕЗИТ). Металлический магний впервые получил в 1808 английский химик Г. Дэви (см. ДЭВИ Гемфри). Как и в случае других активных металлов — натрия, калия, кальция, для получения металлического магния Дэви использовал электролиз. Электролизу он подвергал увлажненную смесь белой магнезии (в ее состав, судя по всему, входили оксид магния MgO и гидроксид магния Mg(OH)2) и оксида ртути HgO. В результате Дэви получил амальгаму — сплав нового металла со ртутью. После отгонки ртути остался порошок нового металла, который Дэви назвал магнием. Магний, полученный Дэви, был довольно грязным, чистый металлический магний получен впервые в 1828 французским химиком А. Бюсси. Нахождение в природе Магний — один из десяти наиболее распространенных элементов земной коры. В ней содержится 2,35% магния по массе. Из-за высокой химической активности в свободном виде магний не встречается, а входит в состав множества минералов — силикатов, алюмосиликатов, карбонатов, хлоридов, сульфатов и др. Так, магний содержат широко распространенные силикаты оливин (см. ОЛИВИН) (Mg,Fe)2[SiO4] и серпентин (см. СЕРПЕНТИН) Mg6(OH)8[Si4O10]. Важное практическое значение имеют такие магнийсодержащие минералы, как асбест (см. АСБЕСТ (минерал)), магнезит (см. МАГНЕЗИТ), доломит (см. ДОЛОМИТ) MgCO3·CaCO3, бишофит (см. БИШОФИТ) MgCl2·6h3O, карналлит (см. КАРНАЛЛИТ) KCl·MgCl2·6h3O, эпсомит (см. ЭПСОМИТ) MgSO4·7h3O, каинит (см. КАИНИТ) KCl·MgSO4·3h3O, астраханит Na2SO4·MgSO4·4h3O и др. Магний содержится в морской воде (4% Mg в сухом остатке), в природных рассолах, во многих подземных водах. Получение Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2, натрия NaCl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния: MgCl2 (электролиз) = Mg + Cl2. Расплавленный металл периодически отбирают из электролизной ванны, а в нее добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много — около 0,1% примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния, или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999% и выше. Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс: MgO + C = Mg + CO или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции: CaCO3·MgCO3 = CaO + MgO + 2CO2, 2MgO + 2CaO + Si = Ca2SiO4 + 2Mg. Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду. Физические и химические свойства Металлический магний обладает гексагональной кристаллической решеткой. Температура плавления 650°C, температура кипения 1105°C, плотность 1,74 г/см3 (магний — очень легкий металл, легче только кальций и щелочные металлы (см. ЩЕЛОЧНЫЕ МЕТАЛЛЫ)). Стандартный электродный потенциал магния Mg/Mg2+ –2,37В. В ряду стандартных потенциалов он расположен за натрием перед алюминием. Поверхность магния покрыта плотной пленкой оксида MgO, при обычных условиях надежно защищающей металл от дальнейшего разрушения. Только при нагревании металла до температуры выше примерно 600°C он загорается на воздухе. Горит магний с испусканием яркого света, по спектральному составу близкого к солнечному. Поэтому раньше фотографы при недостаточной освещенности проводили съемку в свете горящей ленты магния. При горении магния на воздухе образуется рыхлый белый порошок оксида магния MgO: 2Mg + O2 = 2MgO. Одновременно с оксидом образуется и нитрид магния Mg3N2: 3Mg + N2 = Mg3N2. C холодной водой магний не реагирует (или, точнее, реагирует, но крайне медленно), а с горячей водой он вступает во взаимодействие, причем образуется рыхлый белый осадок гидроксида магния Mg(OH)2: Mg + 2h3O = Mg(OH)2 + h3. Если ленту магния поджечь и опустить в стакан с водой, то горение металла продолжается. При этом выделяющийся при взаимодействии магния с водой водород немедленно загорается на воздухе. Горение магния продолжается и в атмосфере углекислого газа: 2Mg + CO2 = 2MgO + C. Способность магния гореть как в воде, так и в атмосфере углекислого газа существенно усложняет тушение пожаров, при которых горят конструкции из магния или его сплавов. (см. МАГНИЯ ОКСИД) Оксид магния (см. МАГНИЯ ОКСИД) MgO представляет собой белый рыхлый порошок, не реагирующий с водой. Раньше его называли жженой магнезией или просто магнезией. Этот оксид обладает основными свойствами, он реагирует с различными кислотами, например: MgO + 2HNO3 = Mg(NO3)2 + h3O. Отвечающее этому оксиду основание Mg(OH)2 — средней силы, но в воде практически нерастворимо. Его можно получить, например, добавляя щелочь к раствору какой-либо соли магния: 2NaOH + MgSO4 = Mg(OH)2 + Na2SO4. Так как оксид магния MgO при взаимодействии с водой щелочей не образует, а основание магния Mg(OH)2 щелочными свойствами не обладает, магний, в отличие от своих «согруппников» — кальция, стронция и бария, не относится к числу щелочноземельных металлов. Металлический магний при комнатной температуре реагирует с галогенами, например, с бромом: Mg + Br2 = MgBr2. При нагревании магний вступает во взаимодействие с серой, давая сульфид магния: Mg + S = MgS. Если в инертной атмосфере прокаливать смесь магния и кокса, то образуется карбид магния состава Mg2C3 (следует отметить, что ближайший сосед магния по группе — кальций — в аналогичных условиях образует карбид состава СаС2). При разложении карбида магния водой образуется гомолог ацетилена — пропин С3Н4: Mg2C3 + 4Н2О = 2Mg(OH)2 + С3Н4. Поэтому Mg2C3 можно назвать пропиленидом магния. В поведении магния есть черты сходства с поведением щелочного металла лития (см. ЛИТИЙ) (пример диагонального сходства элементов в таблице Менделеева). Так, магний, как и литий, реагирует с азотом (реакция магния с азотом протекает при нагревании), в результате образуется нитрид магния: 3Mg + N2= Mg3N2. Как и нитрид лития, нитрид магния легко разлагается водой: Mg3N2 + 6Н2О = 3Mg(ОН)2 + 2NН3. Сходство с литием проявляется у магния и в том, что его карбонат MgCO3 и фосфат Mg3(PO4)2 в воде плохо растворимы, как и соответствующие соли лития. С кальцием магний сближает то, что присутствие в воде растворимых гидрокарбонатов этих элементов обусловливает жесткость воды (см. ЖЕСТКОСТЬ ВОДЫ). Как и в случае гидрокарбоната кальция (см. ст. Кальций (см. КАЛЬЦИЙ)), жесткость, вызванная гидрокарбонатом магния Mg(HCO3)2, — временная. При кипячении гидрокарбонат магния Mg(HCO3)2 разлагается и в осадок выпадает его основной карбонат — гидроксокарбонат магния (MgOH)2CO3: 2Mg(HCO3)2 = (MgOH)2CO3 + 3CO2 + Н2О. Практическое применение до сих пор имеет перхлорат магния Mg(ClO4)2, энергично взаимодействующий с парами воды, хорошо осушающий воздух или другой газ, проходящий через его слой. При этом образуется прочный кристаллогидрат Mg(ClO4)2·6Н2О. Это вещество можно вновь обезводить, нагревая в вакууме при температуре около 300°C. За свойства осушителя перхлорат магния получил название «ангидрон». Большое значение в органической химии имеют магнийорганические соединения (см. МАГНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ), содержащие связь Mg—C. Особенно важную роль среди них играет так называемый реактив Гриньяра — соединения магния общей формулы RMgHal, где R — органический радикал, а Hal = Cl, Br или I. Эти соединения образуются в эфирных растворах при взаимодействии магния и соответствующего органического галоида RHal и используются для самых разнообразных синтезов. Применение Основная часть добываемого магния используется для получения различных легких магниевых сплавов. В состав этих сплавов, кроме магния, входят, как правило, алюминий, цинк, цирконий. Такие сплавы достаточно прочны и находят применение в самолетостроении, приборостроении и для других целей. Высокая химическая активность металлического магния позволяет использовать его при магниетермическом получении таких металлов, как титан, цирконий, ванадий, уран и др. При этом магний реагирует с оксидом или фторидом получаемого металла, например: 2Mg + TiO2 = 2MgO + Ti. 2Mg + UF4 = 2MgF2 + U. Широкое применение находят многие соединения магния, особенно его оксид, карбонат и сульфат. Биологическая роль магния Магний — биогенный элемент (см. БИОГЕННЫЕ ЭЛЕМЕНТЫ), постоянно присутствующий в тканях всех организмов. Он входит в состав молекулы зеленого пигмента растений — хлорофилла (см. ХЛОРОФИЛЛ), участвует в минеральном обмене, активирует ферментные процессы в организме, повышает засухоустойчивость растений. С участием ионов Mg+осуществляется биолюминесценция (см. БИОЛЮМИНЕСЦЕНЦИЯ) и ряд других биологических процессов. Широкое практическое применение находят магниевые удобрения — доломитовая мука, жженая магнезия и др. В организм животных и человека магний поступает с пищей. Суточная потребность человека в магнии — 0,3—0,5 г. В организме среднего человека (масса тела 70 кг) содержится около 19 г магния. Нарушения обмена магния приводят к различным заболеваниям. В медицине применяют препараты магния — его сульфат, карбонат, жженую магнезию.de.academic.ru
Поиск по сайту
Email рассылка
Узнавай первым
об обновлениях на сайте по Email БЕСПЛАТНО! Как только на сайте появятся новые посты, видео или фото, Ты сразу же будешь извещен об этом одним из первых.
Новое на сайте
Новое на форуме
Нет сообщений для показа